题目内容
19.教材回顾:相同条件下,金属单质活动性越强,其与酸溶液发生反应越剧烈.化学学习小组在老师的帮助下对金属与稀硫酸反应情况的进行深入的实验探究.
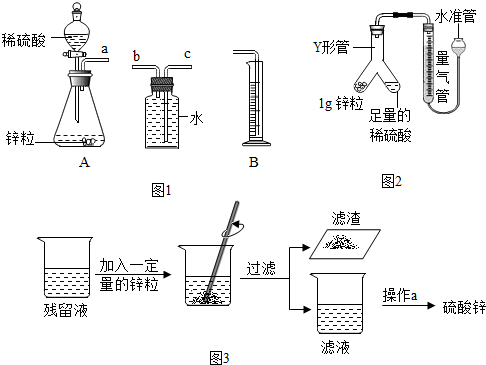
[实验探究一]影响金属锌与稀硫酸反应剧烈程度的因素有哪些?
[作出猜想]小芳同学:金属锌的形状可能影响反应剧烈程度.
小华同学:稀硫酸的溶质质量分数可能影响反应剧烈程度.
(1)锌与稀硫酸反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(2)反应剧烈程度体现在单位时间内反应得到氢气体积的大小.利用如图1的仪器可以组装一套实验室测量取氢气体积的装置,该装置导管的连接顺序是a→b→c→d.其中量筒的作用是由量筒内水的体积读出气体的体积.
[实验验证]某化学课外小组的同学用不同浓度的硫酸和不同形状的锌进行以下四组实验.
| 实验编号 | 硫酸的浓度 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3min) |
| ① | 20% | 大颗粒 | 31.7 |
| ② | 20% | 小颗粒 | 50.9 |
| ③ | 30% | 大颗粒 | 61.7 |
| ④ | 30% | 小颗粒 | 79.9 |
(4)比较实验①和②,可以得到的结论是锌与硫酸的接触面积越大,反应速率越快.
(5)该小组同学进行第①组实验的详细数据如表所示:
| 时段 | 第1min | 第2min | 第3min | 第4min | 第5min | 第6min |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
②锌与稀硫酸反应第2min后开始变慢的主要原因随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢.
[实验探究二]如何测定锌粒(杂质不与稀硫酸反应)中锌的质量分数?
(6)提出问题:利用实验探究一的装置进行实验测出的气体体积偏大,原因是测量出的体积实际为反应产生氢气的体积与锥形瓶中原有的空气之和.
(7)针对上述问题,同学们对实验装置进行改进:利用如图2装置(固定仪器的装置已略)进行实验,可准确地测量氢气体积.
在读取量气管中液面读数的过程中,应注意AC(填字母编号).
A.读数前应上下移动水准管,待两管液面相平再读数
B.保持水准管静止,待水准管中液面不再上升时再读数
C.读数时视线与凹液面最低处相平
(8)当装置恢复至常温时,测得反应生成氢气的体积为280mL(氢气的密度为0.09g/L).根据化学方程式计算,锌粒(杂质不与稀硫酸反应)中锌的质量分数为80%.
[拓展应用]如何回收硫酸锌?
将实验探究一和二的反应残留液放于烧杯中按如图3所示实验操作流程回收硫酸锌,
请回答:
(9)加入一定量的锌粒以除去残留液中过量的稀硫酸,当观察到不再有气泡生成(填实验现象),则稀硫酸已完全反应.
(10)操作a是过滤(填操作名称).操作a中玻璃棒的作用是引流.
[归纳提升]利用金属与稀硫酸的反应情况来比较镁和锌的金属活动性强弱.
(11)设计实验方案:把表面积相等的镁和锌放到等质量、等质量分数的稀硫酸中,观察金属表面产生气泡的快慢.
分析 (1)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(2)根据实验的目的和装置的特点分析连接的顺序;
(3)根据对比试验要确定好常量和变量进行分析;
(4)通过不同质量分数的硫酸或不同形状的锌的产生氢气的快慢得出结论;
(5)根据表格的数据总结产生的氢气与时间的关系;
(6)了解利用该装置测得反应生成气体体积偏大的最主要原因;
(7)测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差;
(8)依据锌粒与稀硫酸反应生成氢气进行分析解答;
(9)根据锌粒与稀硫酸反应生成氢气进行分析;
(10)根据过滤进行分析;
(11)由金属活动性顺序:排在氢前面的金属可置换出酸中的氢,且金属的活动性越强,反应速度越快.
解答 解:(1)锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
故填:Zn+H2SO4═ZnSO4+H2↑;
(2)实验室要测量取氢气体积,应将A装置制得的气体排出,再连接bc,再连接进入到量筒内,由量筒内水的体积读出气体的体积.所以,该装置导管的连接顺序是:a接b接c接d,量筒的作用是由量筒内水的体积读出气体的体积;故填:b;c;由量筒内水的体积读出气体的体积;
(3)比较不同浓度的硫酸对反应快慢的影响时,锌的质量和形状要完全一样,应选择的实验编号是①③或②④;故填:①③或②④;
(4)通过①②(锌粒的颗粒大小不同,与质量分数相同的硫酸反应)可以看出:锌与硫酸的接触面积越大,反应速率越快;故填:锌与硫酸的接触面积越大,反应速率越快;
(5)①从表格可以看出反应由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,由此猜想化学反应剧烈程度还与温度有关;
②但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
故填:①放热;温度;
②随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
(6)了解利用该装置测得反应生成气体体积偏大的最主要原因:锥形瓶中原有的空气混入制取的气体中,故填:锥形瓶中原有的空气;
(7)为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意:读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差;故选AC;
(8)解:设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.09 g/L×0.28 L
$\frac{65}{2}$=$\frac{x}{0.09g/L×0.28L}$ 解得X≈0.8 g
锌粒中锌的质量分数:$\frac{0.8g}{1g}$×100%=80.0%
故填:80.0%;
(9)加入一定量的锌粒以除去残留液中过量的稀硫酸,当不再有气泡生成,则稀硫酸完全反应,故填:不再有气泡生成;
(10)操作a是过滤,玻璃棒的作用是引流,故填:过滤;引流;
(11)镁和锌都能与稀硫酸反应,反应时活动性强的镁比活动性弱的锌铁反应剧烈,所以把表面积相等的镁和锌放到等质量、等质量分数的稀硫酸中,观察金属表面产生气泡的快慢,故填:把表面积相等的镁和锌放到等质量、等质量分数的稀硫酸中,观察金属表面产生气泡的快慢.
点评 本题考查了锌和稀硫酸的反应,综合性很强,有一定难度,需认真理解.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | 均一稳定的液体一定是溶液 | B. | 洗涤剂去油污是乳化现象 | ||
| C. | 豆浆、牛奶都是溶液 | D. | 溶液都是无色的 |
| A. | 复合肥 | B. | 磷肥 | C. | 钾肥 | D. | 氮肥 |
| 实验操作 | 实验现象 | 结论 |
| 取一金属铁丝放入一只试管中,滴加“除垢净”少许. | 产生气泡 | 猜想正确 |
| 取少量苏打粉即碳酸钠粉末,滴加“除垢净”少许. | 产生气泡 | 猜想正确 |
【查阅资料】水垢的主要成分是Mg(OH)2和CaCO3.
【设计实验】
(1)甲同学取“除垢剂”少许,滴几滴无色酚酞试液,溶液为无色,则得出结论:“除垢剂”的成分中含有酸.乙同学认为:据此还不能得出这样的结论,理由是无色酚酞在酸性或中性溶液中都显无色.
(2)乙同学从家中找来两种物质继续做了如下两个实验
(3)同学们想试制一瓶“除垢剂”,甲同学认为选用稀硫酸作“除垢剂”合适,乙同学认为不妥,其理由是碳酸钙与硫酸反应生成的硫酸钙微溶于水,阻碍反应的进行.
【反思】热水壶内的水垢还可以用厨房中的食醋来除去.
①地面建筑产生大量粉尘 ②沙尘暴天气增多 ③太阳能热水
④汽车尾气的大量排放 ⑤燃烧天然气 ⑥燃煤取暖.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | ①②④⑥ | D. | ③④⑤⑥ |
| A. | 食用霉变的花生 | B. | 合理摄入人体必需元素 | ||
| C. | 使用可降解塑料餐盒 | D. | 用灼烧发鉴别合成纤维和羊毛纤维 |
| A. | 用嘴吹灭酒精灯 | |
| B. | 实验桌上酒精着火用湿抹布盖灭 | |
| C. | 为避免浪费,实验用剩的药品放回原试剂瓶 | |
| D. | 取用粉末状固体药品用药匙,取用块状固体药品直接用手拿 |
| A. | 烧碱变质 | B. | 盐酸挥发 | C. | 稀释浓酸 | D. | 试管破碎 |

