题目内容
11.黄铜是铜锌合金,黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如图(杂质不溶于水、不参与反应):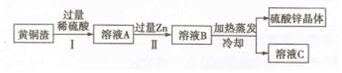
已知:ZnO+H2SO4═ZnSO4+H2O;CuO+H2SO4═CuSO4+H2O
(1)证明步骤Ⅰ中稀硫酸过量的方法是取少量溶液于试管中,加入铁粉,产生气泡;
(2)步骤Ⅱ中反应的化学方程式为Zn+CuSO4═ZnSO4+Cu,或Zn+H2SO4═ZnSO4+H2↑(写一个即可);
(3)步骤Ⅰ、Ⅱ中均包含的操作是过滤;得到的溶液C一定(填“一定”或“不一定”)是硫酸锌的饱和溶液;
(4)写出黄铜在日常生产生活中的一种用途制作无缝铜管.
分析 (1)铜不能和稀硫酸反应,稀硫酸能和锌反应生成硫酸锌和氢气,能和氧化锌反应生成硫酸锌和水,能和氧化铜反应生成硫酸铜和水,能和铁反应生成硫酸亚铁和氢气;
(2)锌比铜活泼,能和硫酸铜反应生成硫酸锌和铜;
(3)步骤Ⅰ、Ⅱ中均包含的操作是过滤,通过过滤能够把液体和固体分离;
析出晶体后的溶液是该晶体的饱和溶液.
(4)黄铜在日常生产生活中可以用来制作无缝铜管.
解答 解:(1)铁能和稀硫酸反应生成硫酸亚铁和氢气,因此证明步骤Ⅰ中稀硫酸过量的方法是:取少量溶液于试管中,加入铁粉,产生气泡.
故填:取少量溶液于试管中,加入铁粉,产生气泡.
(2)步骤Ⅱ中,锌和硫酸铜反应生成硫酸锌和铜,和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑.
故填:Zn+CuSO4═ZnSO4+Cu,或Zn+H2SO4═ZnSO4+H2↑.
(3)步骤Ⅰ、Ⅱ中均包含的操作是过滤;
得到的溶液C一定是硫酸锌的饱和溶液.
故填:过滤;一定.
(4)黄铜在日常生产生活中可以用来制作无缝铜管.
故填:制作无缝铜管.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
19.酸和碱混合后的溶液可能呈酸性,以下证明酸过量的操作及现象的叙述中正确的是( )
| A. | 加入金属铜片,产生气泡 | B. | 滴加石蕊溶液,溶液变红色 | ||
| C. | 加入蒸馏水,溶液颜色不变 | D. | 滴加酚酞溶液,溶液为无色 |





