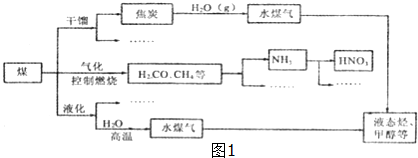
题目内容
2. 如图装置既可以用于排空气法又可以用于排水法收集气体.无论瓶内装满空气还是装满水,收集气体时,制的气体都从b端进入,该气体是( )
如图装置既可以用于排空气法又可以用于排水法收集气体.无论瓶内装满空气还是装满水,收集气体时,制的气体都从b端进入,该气体是( )| A. | O2 | B. | CO2 | C. | H2 | D. | CO |
分析 收集方法的选择是根据:难溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集.
解答 解:用图示装置收集气体时:如果用排空气法收集气体时,密度比空气“大”的气体要从“长”的进,密度比空气“小”的气体要从“短”的进,用排水法时,气体要从“短”的进;由于氢气的密度比空气小所以从短的一端进.
故选:C.
点评 本题难度不大,掌握气体收集装置的选择依据即可顺利解答.

练习册系列答案
相关题目
14.下列为某同学对化学知识的归纳,其中有错误的是( )
| A. | 空气的组成:氮气、氧气、氢气、稀有气体等 | |
| B. | 燃烧的三个条件:可燃物、氧气、温度达到着火点 | |
| C. | 区别O2和CO2两种物质可用的方法之一是:燃着的木条 | |
| D. | 选取实验室制取气体发生装置的依据是:反应的条件和反应物的状态 |
17.把A、B、C、D四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质的质量如表:
(1)反应后D的质量是19.6g;
(2)参加反应的B的质量是24.5g;
(3)容器中发生反应的反应类型是分解反应(填写基本反应类型);
(4)物质C可能是催化剂.
| 物质 | A | B | C | D |
| 反应前质量/g | 2 | 26.5 | 2 | 10 |
| 反应后质量/g | 16.9 | 2 | 2 | 待测 |
(2)参加反应的B的质量是24.5g;
(3)容器中发生反应的反应类型是分解反应(填写基本反应类型);
(4)物质C可能是催化剂.
14.最近科学家发现,水在-157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠.下列关于这种“高密度液态水”的说法正确的是( )
| A. | 构成“高密度液态水”的分子与普通水的分子不同 | |
| B. | “高密度液态水”分子不再运动 | |
| C. | “高密度液态水”中氢、氧两种元素的质量比为1:8 | |
| D. | “高密度液态水”分子间的间隔比普通水大 |
12. 在实验室中,同学们设计了如图所示装置制取纯净的CO2,查阅资料知,饱和碳酸氢钠溶液可以吸收HCl气体而不吸收CO2.硝酸银溶液与氯化氢气体反应生成氯化银白色沉淀.有关该实验同学们提出了下列四种说法,其中不正确的是( )
在实验室中,同学们设计了如图所示装置制取纯净的CO2,查阅资料知,饱和碳酸氢钠溶液可以吸收HCl气体而不吸收CO2.硝酸银溶液与氯化氢气体反应生成氯化银白色沉淀.有关该实验同学们提出了下列四种说法,其中不正确的是( )
 在实验室中,同学们设计了如图所示装置制取纯净的CO2,查阅资料知,饱和碳酸氢钠溶液可以吸收HCl气体而不吸收CO2.硝酸银溶液与氯化氢气体反应生成氯化银白色沉淀.有关该实验同学们提出了下列四种说法,其中不正确的是( )
在实验室中,同学们设计了如图所示装置制取纯净的CO2,查阅资料知,饱和碳酸氢钠溶液可以吸收HCl气体而不吸收CO2.硝酸银溶液与氯化氢气体反应生成氯化银白色沉淀.有关该实验同学们提出了下列四种说法,其中不正确的是( )| A. | ①中固体反应物也可用Na2CO3代替 | |
| B. | ③中没有白色沉淀产生,说明CO2气体中已经不混有HCl气体 | |
| C. | ④中浓H2SO4的作用是吸收CO2气体中混有的H2O | |
| D. | 将燃着的小木条放在⑤中的集气瓶口,可以检验集气瓶是否收集满CO2 |