题目内容
18.为了测定碳酸钙和氯化钙混合物的组成情况.某学习小组同学取21.lg混合物样品进行了如下图所示的实验: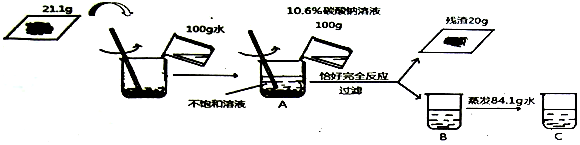
请回答下列问题:
(1)写出发生反应的化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)列出求解生成沉淀质量(X)的比例式$\frac{106}{100g×10.6%}=\frac{100}{x}$(合理即可);
(3)混合物样品中碳酸钙与氯化钙的质量比为100:111;
(4)C中所得溶液溶质的质量分数为10%;
(5)上述所用的碳酸钠溶液是由26.5%的碳酸钠溶液配制的,需要26.5%的碳酸钠溶液的质量是40g.
分析 (1)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠进行分析;
(2)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,依据碳酸钠的质量计算生成碳酸钙的质量以及氯化钙和氯化钠的质量;
(3)根据化学方程式计算出混合物中氯化钙的质量,计算混合物中各成分的质量比;
(4)根据所求氯化钠的质量以及溶液的总质量求算;
(5)根据溶液稀释过程溶质质量不变求算.
解答 解:(1)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)设生成碳酸钙沉淀质量为x,参加反应的氯化钙质量为y,生成氯化钠质量为z,
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
y 100g×10.6% x z
$\frac{111}{y}=\frac{106}{100g×10.6%}=\frac{100}{x}=\frac{117}{z}$
x=10g
y=11.1g
z=11.7g
(3)所以混合物中碳酸钙质量为:21.1g-11.1g=10g,碳酸钙与氯化钙的质量比是:10g:11.1g=100:111;
(4)所得C溶液中氯化钠的质量分数为$\frac{11.7g}{21.1g+100g+100g-20g-84.1g}$×100%=10%;
(5)由于所用碳酸钠溶液为100g10.6%,所以需要26.5%的碳酸钠溶液的质量是$\frac{100g×10.6%}{26.5%}$=40g.
故答案为:(1)CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)$\frac{106}{100g×10.6%}=\frac{100}{x}$;
(3)100:111;
(4)10%;
(5)40g.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 使用燃煤脱硫技术,防止SO2污染 | |
| B. | 大力实施绿化工程,防治扬尘污染 | |
| C. | 对垃圾进行分类处理,回收利用 | |
| D. | 把废旧电池、电瓶埋入土中,防止重金属污染 |
| A. | -1 | B. | +1 | C. | -4 | D. | +4 |
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 硝酸钾溶解度(g) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| 氯化钠溶解度(g) | 35.7 | 5.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |

(1)依据如表数据,可绘制出硝酸钾和氯化钠的溶解度曲线如图所示,图中能表示硝酸钾溶解度曲线的是A(填“A”或“B”);
(2)图中两溶解度曲线相交于P点,此点表示的意义是24℃时,硝酸钾和氯化钠的溶解度相等;
(3)20℃时,把50gA物质放入盛有100g水的烧杯中,充分搅拌,可得该温度下的饱和(填“饱和”或“不饱和”)溶液,若烧杯内物质缓慢升温至60℃,此时所得溶液中溶质与溶液的质量之比为1:3(填最简整数比).
| A. | 生石灰 | B. | 食醋 | C. | 苹果汁 | D. | 食盐 |

| A. | 该反应中H2S被氧化 | |
| B. | 反应前后各元素的化合价均不变 | |
| C. | 化学反应前后分子个数保持不变 | |
| D. | 参加反应的两种分子的个数比为4:2 |
 常温下,在盛有22.3g Na2CO3和NaCl固体混合物的烧杯中,逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
常温下,在盛有22.3g Na2CO3和NaCl固体混合物的烧杯中,逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
 如图是A、B、C三种物质(均不含结晶水)的溶解度曲线,请回答:
如图是A、B、C三种物质(均不含结晶水)的溶解度曲线,请回答: