题目内容
5.科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.如图1所示在四支试管中分别加入0.2克二氧化锰(MnO2)粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生的速度,记录如表:| 实验次数 | 1 | 2 | 3 | 4 |
| H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
| MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
| 气泡产生的速度 | + | ++ | +++ | ++++ |
(1)由实验方案可知,他们建立的假设是过氧化氢溶质质量分数越大,过氧化氢分解的速度越快.
(2)小明认为上述实验还说明了MnO2能促进过氧化氢的分解,小红觉得不合理.你认为小红的理由是该实验没有设置对照组.
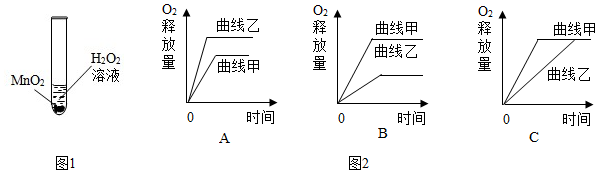
(3)小红用一定质量某溶质质量分数的H2O2溶液和二氧化锰(MnO2)粉末制取氧气,产生氧气,做出氧气释放量和时间的关系图(曲线甲);小明用相同质量、相同溶质质量分数的H2O2溶液在相同条件下制取氧气,但忘记加二氧化锰,也做出氧气释放量与时间的关系图(曲线乙).曲线甲、乙正确的可能是如图2中的C.
分析 (1)根据实验中所给数据分析建立假设;
(2)根据控制变量法分析实验;
(3)根据二氧化锰不能改变产生氧气的量,只能改变反应速率,产生氧气的多少取决于过氧化氢的质量.
解答 解:(1)观察表格二氧化锰的质量相同,而过氧化氢溶质质量分数不同,过氧化氢的质量分数越大,气泡产生越多,速度越快,因此可假设为:过氧化氢溶质质量分数越大,过氧化氢分解的速度越快;故答案为:过氧化氢溶质质量分数越大,过氧化氢分解的速度越快;
(2)由于表格中都使用二氧化锰,如果没有二氧化锰,产生氧气的速率如何没有探究,故不能说明二氧化锰对过氧化氢的分解有促进作用;故答案为:该实验没有设置对照组;
(3)用相同质量、相同溶质质量分数的H2O2溶液在相同条件下制取氧气,产生的氧气相等,用二氧化锰反应的速率快,观察曲线,故正确的是:C.
故答案为:
(1)过氧化氢溶质质量分数越大,过氧化氢分解的速度越快;(2)该实验没有设置对照组;(3)C.
点评 通过回答本题知道了影响过氧化氢反应速度的因素,要求能够在分析实验数据的基础上得到正确结论,是对学生分析能力的考查.

练习册系列答案
相关题目
15. 用如图所示装置电解水,反应一段时间后,对有关现象和结论描述正确的是( )
用如图所示装置电解水,反应一段时间后,对有关现象和结论描述正确的是( )
 用如图所示装置电解水,反应一段时间后,对有关现象和结论描述正确的是( )
用如图所示装置电解水,反应一段时间后,对有关现象和结论描述正确的是( )| A. | 乙试管中收集到的气体能支持燃烧 | |
| B. | 甲、乙两试管中收集到的气体质量比为2:1 | |
| C. | 甲、乙两试管中收集到的气体体积比为1:2 | |
| D. | 水是由氢气和氧气组成的 |
10.利用化学实验可以鉴别生活中的一些物质.如表中各组物质的鉴别方法能将本组待鉴别物质都区分出来的是( )
| A | B | C | D | |
| 实验要求 | 鉴别氧气和氮气 | 鉴别二氧化碳和氮气 | 鉴别酒精和水 | 鉴别呼出气体和吸入的空气 |
| 第一方案 | 观察颜色 | 闻气味 | 闻气味 | 闻气味 |
| 第二方案 | 分别伸入带火星的木条 | 分别通入澄清石灰水 | 取样,分别用燃着的木条检验 | 分别伸入带火星的木条 |
| A. | A | B. | B | C. | C | D. | D |
14.当今世界面临的三大环境问题是酸雨、臭氧层衰竭和温室效应,其中形成酸雨的主要原因是人们向空气中排放大量的( )
| A. | CO | B. | CO2 | C. | SO2 | D. | Fe2O3 |
9.下列变化,属于化学变化的是( )
| A. | 冰雪融化 | B. | 酒精燃烧 | C. | 开水沸腾 | D. | 铁丝弯曲 |

