题目内容
16.氯乙烷(C2H5Cl)是运动场上常使用的一种喷雾止痛剂.试计算:(1)氯乙烷的相对分子质量为64.5.
(2)氯乙烷中碳、氢、氯元素的质量比等于48:10:71.
(3)氯乙烷中碳元素的质量分数为多少?(要有计算过程,精确到0.1%)
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分解答.
(3)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
解答 解:(1)氯乙烷(C2H5Cl)的相对分子质量为12×2+1×5+35.5=64.5.
(2)氯乙烷中碳、氢、氯元素的质量比为(12×2):(1×5):35.5=48:10:71.
(3)氯乙烷中碳元素的质量分数为$\frac{12×2}{64.5}×$100%≈37.2%.
故答案为:
(1)64.5;(2)48:10:71;(3)37.2%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
6.下列物质在氧气里燃烧,能生成黑色固体的是( )
| A. | 铁丝 | B. | 硫 | C. | 木炭 | D. | 红磷 |
8.下列有关氧气的说法正确的是( )
| A. | 氧气具有可燃性 | B. | 空气中含量最多的是氧气 | ||
| C. | 夏天食物腐烂与氧气无关 | D. | 通常用带火星的木条检验氧气 |
5.科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.如图1所示在四支试管中分别加入0.2克二氧化锰(MnO2)粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生的速度,记录如表:
注:“+”表示气泡产生的速度,“+”越多,速度越快.
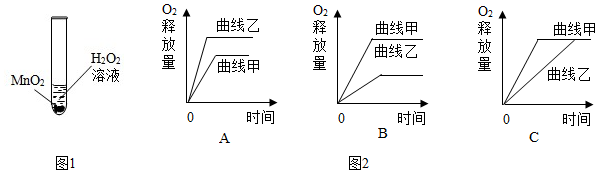
(1)由实验方案可知,他们建立的假设是过氧化氢溶质质量分数越大,过氧化氢分解的速度越快.
(2)小明认为上述实验还说明了MnO2能促进过氧化氢的分解,小红觉得不合理.你认为小红的理由是该实验没有设置对照组.
(3)小红用一定质量某溶质质量分数的H2O2溶液和二氧化锰(MnO2)粉末制取氧气,产生氧气,做出氧气释放量和时间的关系图(曲线甲);小明用相同质量、相同溶质质量分数的H2O2溶液在相同条件下制取氧气,但忘记加二氧化锰,也做出氧气释放量与时间的关系图(曲线乙).曲线甲、乙正确的可能是如图2中的C.
| 实验次数 | 1 | 2 | 3 | 4 |
| H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
| MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
| 气泡产生的速度 | + | ++ | +++ | ++++ |

(1)由实验方案可知,他们建立的假设是过氧化氢溶质质量分数越大,过氧化氢分解的速度越快.
(2)小明认为上述实验还说明了MnO2能促进过氧化氢的分解,小红觉得不合理.你认为小红的理由是该实验没有设置对照组.
(3)小红用一定质量某溶质质量分数的H2O2溶液和二氧化锰(MnO2)粉末制取氧气,产生氧气,做出氧气释放量和时间的关系图(曲线甲);小明用相同质量、相同溶质质量分数的H2O2溶液在相同条件下制取氧气,但忘记加二氧化锰,也做出氧气释放量与时间的关系图(曲线乙).曲线甲、乙正确的可能是如图2中的C.
6.O2与CO2按m:n的分数个数比混合后与过量的红热焦炭充分反应,所得气体分子总数是反应前O2与CO2分子数总和的( )
| A. | 4mn倍 | B. | 2(m+n)倍 | C. | 2mn倍 | D. | 2倍 |