题目内容
14.当今世界面临的三大环境问题是酸雨、臭氧层衰竭和温室效应,其中形成酸雨的主要原因是人们向空气中排放大量的( )| A. | CO | B. | CO2 | C. | SO2 | D. | Fe2O3 |
分析 根据酸雨主要是一些酸性气体升到空中与空气中的水蒸汽结合,使雨水酸化.罪魁祸首是煤、石油大量燃烧生成的酸性气体解答.
解答 解:二氧化硫、氮氧化物等物质,能和水反应生成酸,当酸在雨水中溶解达到一定程度时,即pH<5.6时,就形成酸雨.
故选:C.
点评 本题主要考查酸雨的形成原因;酸性气体的大量排放.这里的酸性气体溶于水后生成一些酸性较强的酸.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.如图1所示在四支试管中分别加入0.2克二氧化锰(MnO2)粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生的速度,记录如表:
注:“+”表示气泡产生的速度,“+”越多,速度越快.
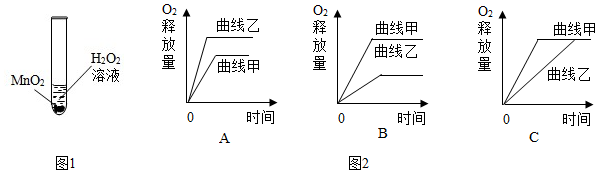
(1)由实验方案可知,他们建立的假设是过氧化氢溶质质量分数越大,过氧化氢分解的速度越快.
(2)小明认为上述实验还说明了MnO2能促进过氧化氢的分解,小红觉得不合理.你认为小红的理由是该实验没有设置对照组.
(3)小红用一定质量某溶质质量分数的H2O2溶液和二氧化锰(MnO2)粉末制取氧气,产生氧气,做出氧气释放量和时间的关系图(曲线甲);小明用相同质量、相同溶质质量分数的H2O2溶液在相同条件下制取氧气,但忘记加二氧化锰,也做出氧气释放量与时间的关系图(曲线乙).曲线甲、乙正确的可能是如图2中的C.
| 实验次数 | 1 | 2 | 3 | 4 |
| H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
| MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
| 气泡产生的速度 | + | ++ | +++ | ++++ |

(1)由实验方案可知,他们建立的假设是过氧化氢溶质质量分数越大,过氧化氢分解的速度越快.
(2)小明认为上述实验还说明了MnO2能促进过氧化氢的分解,小红觉得不合理.你认为小红的理由是该实验没有设置对照组.
(3)小红用一定质量某溶质质量分数的H2O2溶液和二氧化锰(MnO2)粉末制取氧气,产生氧气,做出氧气释放量和时间的关系图(曲线甲);小明用相同质量、相同溶质质量分数的H2O2溶液在相同条件下制取氧气,但忘记加二氧化锰,也做出氧气释放量与时间的关系图(曲线乙).曲线甲、乙正确的可能是如图2中的C.
2. 关于如图粒子结构示意图的说法中,错误的是( )
关于如图粒子结构示意图的说法中,错误的是( )
 关于如图粒子结构示意图的说法中,错误的是( )
关于如图粒子结构示意图的说法中,错误的是( )| A. | 它们分别属于三种元素的离子 | |
| B. | 它们都有相对稳定的结构 | |
| C. | 由前两种粒子直接构成的物质是MgF2 | |
| D. | 它们的核外都有2个电子层 |
19.利用如图所示装置,下列操作不能完成实验要求的是( )


| A. | 若证明鸡蛋壳的主要成分是碳酸盐,将A装置的a导气管与C装置的d导气管相连 | |
| B. | 若制取干燥的二氧化碳,用D装置收集,导管口的链接顺序是a→b→c→f | |
| C. | 若A装置中放入稀硫酸和锌粒,用D装置收集干燥氢气,导管口的连接顺序是a→b→c→f | |
| D. | 若A装置中放入稀硫酸和锌粒,在D装置中装满水,再连接量筒,气体应从f导管口进入装置D,就可以测定生成氢气的体积 |
6.O2与CO2按m:n的分数个数比混合后与过量的红热焦炭充分反应,所得气体分子总数是反应前O2与CO2分子数总和的( )
| A. | 4mn倍 | B. | 2(m+n)倍 | C. | 2mn倍 | D. | 2倍 |
17.下列化学用语表示正确的是( )
| A. | 2O 2个氧元素 | B. | H2 2个氢原子 | C. | Ca+2 钙离子 | D. | 2Cl2 2个氯分子 |
18.下列有关化合反应和氧化反应的说法中正确的是( )
| A. | 化合反应属于氧化反应 | |
| B. | 某些氧化反应属于化合反应 | |
| C. | 氧化反应是指物质与氧气的反应 | |
| D. | 化合反应是指由多种物质生成新物质的反应 |