题目内容
15.现有一包已初步提纯的粗盐,经测定仍含有少量的氯化钙,某同学按下列步骤进行探究,以确定粗盐中氯化钠的质量分数.①称取10g粗盐样品,加水溶解,制成粗盐溶液;
②向溶液中加入过量的某试剂,过滤;
③将沉淀洗涤后小心烘干,得到纯净固体A;
④对滤液进行“某一操作”后,移入蒸发皿蒸发,得到纯净的固体B;
⑤称量实验中得到的某种固体.
请回答:
(1)该同学在步骤②中加入过量的试剂是Na2CO3(填化学式)其目的是除去杂质CaCl2.步骤④进行的“某一操作”是滤液中逐滴加入稀盐酸,到不再产生气体为止,目的是除去过量的碳酸钠.
(2)在①②④步中都用到同一仪器玻璃棒(填名称);它在①和④中的操作方法相同,但作用不同,在①中的作用为,在④中的作用为防止受热不匀液滴溅出.
(3)在实验第⑤步中称量的固体是A(填A或B),理由是蒸发所得到的氯化钠,是原有氯化钠与碳酸钠和杂质氯化钙反应及盐酸反应所得到的氯化钠的总和.
分析 (1)根据向粗盐溶液加入过量的某种试剂,和氯化钙反应产生沉淀分析;根据④过量的碳酸钠可以用盐酸除去,最后得到氯化钠分析;
(2)根据①②④的操作分析需要的共同仪器及溶解时玻璃棒的作用进行分析;
(3)根据固体A是氯化钙和碳酸钠反应产生的碳酸钙沉淀可以计算氯化钙的质量,从而知道样品中氯化钠的质量;而固体B中,不是原来的氯化钠,有新生成的氯化钠进行分析.
解答 解:(1)通过分析可知,该同学在步骤②中加入过量的试剂是Na2CO3,其目的是除去杂质CaCl2.步骤④进行的“某一操作”是滤液中逐滴加入稀盐酸,到不再产生气体为止,目的是除去过量的碳酸钠;
(2)在①②④步中都用到同一仪器玻璃棒;它在①和④中的操作方法相同,但作用不同,在①中的作用为加速溶解,在④中的作用为:防止受热不匀液滴溅出;
(3)步骤⑤中需要称量的固体是A,固体A是氯化钙和碳酸钠反应产生的碳酸钙沉淀可以计算氯化钙的质量,从而计算样品中氯化钠的质量和质量分数;而固体B中,不是原来的氯化钠,有新生成的氯化钠,因此不正确.
故答案为:(1)Na2CO3,除去杂质CaCl2,滤液中逐滴加入稀盐酸,到不再产生气体为止,除去过量的碳酸钠;
(2)玻璃棒;加快溶解;防止受热不匀液滴溅出;
(3)A,蒸发所得到的氯化钠,是原有氯化钠与碳酸钠和杂质氯化钙反应及盐酸反应所得到的氯化钠的总和.
点评 本考点属于验证性的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.在解此类题时,首先要从众多的叙述中找出与解题有关的叙述,然后根据要求选择适当的试剂和方法进行解答,通过该题,要会求粗盐中氯化钠的质量分数.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
20.下列有关溶液的说法中正确的是( )
| A. | 均一、稳定的液体都是溶液 | |
| B. | 饱和溶液一定比不饱和溶液浓 | |
| C. | 溶液一定是液体 | |
| D. | 餐具上的油污可利用洗涤剂的乳化功能将其洗去 |
4.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动,以下是教学片断,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想三,理由是H2SO4和NaOH在溶液中不能共存.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中.
②实验方案中也有一个是错误的,错误的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想三,理由是H2SO4和NaOH在溶液中不能共存.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 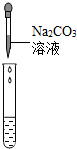 | 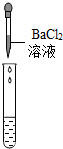 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中.
②实验方案中也有一个是错误的,错误的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.

