题目内容
10.现有①铁屑;②钢;③水;④干冰;⑤过氧化氢;⑥盐酸;⑦臭氧;⑧氯酸钾和二氧化锰完全反应的剩余固体,其中属于单质的是①⑦(填序号,下同),属于氧化物的是③④⑤,属于混合物的是②⑥⑧.分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.
解答 解:铁屑、臭氧是由一种元素组成的纯净物,属于单质;
水、干冰、过氧化氢都是由两种元素组成的化合物,其中一种元素是氧元素,都属于氧化物;
钢、盐酸、氯酸钾和二氧化锰完全反应的剩余固体都是由多种物质组成的,都属于混合物;
故答案为:①⑦;③④⑤;②⑥⑧.
点评 应抓住概念的要点来判断物质的类别,了解常见物质的组成.

练习册系列答案
相关题目
15.从物质分类的角度分析,KClO3属于( )
| A. | 混合物 | B. | 氧化物 | C. | 化合物 | D. | 单质 |
2.下列比较玻璃、有机玻璃、聚酯塑料的方法、现象,结论完全正确的是( )
| A. | 分别将样品摔在瓷砖上,均没碎裂 | |
| B. | 分别将样品在强光下照射,不透明的是聚酯塑料 | |
| C. | 分别将样品用铁制小刀刻画,没有痕迹留下的是有机玻璃 | |
| D. | 分别将样品在酒精灯火焰上灼烧一会儿,没有变化的是玻璃 |
14. “双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下反应生成氯化亚铁:
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整.
【实验质疑】小组同学通过讨论认为实验并不能得出一定不含Fe2O3的结论,理由是:Fe2O3+6HCl═2FeCl3+3H2O、Fe+2FeCl3=3FeCl2(用化学方程式表示).
为进一步确定这包久置的“双吸剂”固体的成分迸行如下定量实验.
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照下图流程进行实验:
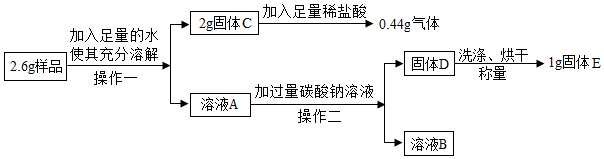
(1)操作一、操作二为相同的操作,该操作为过滤;
(2)固体C的成分是CaCO3和Fe2O3(填化学式,下同);
(3)溶液A中加入碳酸钠溶液反应方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,检验所加碳酸钠溶液是否过量的方法是:静置向上层清夜中加Na2CO3溶液(或碳酸钾溶液),若无沉淀生成,则已过量;
(4)确定固体E是否洗涤干净的方法是:取最后一次洗涤液加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净;
(5)依据实验探究1、2中现象的分析及数据计算判断出这包久置“双吸剂”固体的成分是Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验反思】下列对实验探究1、2的反思,不正确的是D(填字母序号).
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2溶液B中的溶质为Na2CO3和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加入足量稀盐酸有4个反应发生.
 “双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下反应生成氯化亚铁:
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品放入试管中,滴加一定量的 稀盐酸,用带导管的单孔橡皮塞塞紧试管口,导管另一端伸入澄清石灰水中 | 试管中固体逐渐溶解,有大量气泡产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有 Fe、CaCO3, 不含Fe2O3. |
| ②取少量样品放入试管中,加水,静置向上层清液中滴加无色酚酞试液 | 放出大量的热量,试管底部有不溶物,酚酞试液由无色变为红色. | 样品中含有 氧化钙或氢氧化钙或二者都有. |
为进一步确定这包久置的“双吸剂”固体的成分迸行如下定量实验.
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照下图流程进行实验:

(1)操作一、操作二为相同的操作,该操作为过滤;
(2)固体C的成分是CaCO3和Fe2O3(填化学式,下同);
(3)溶液A中加入碳酸钠溶液反应方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,检验所加碳酸钠溶液是否过量的方法是:静置向上层清夜中加Na2CO3溶液(或碳酸钾溶液),若无沉淀生成,则已过量;
(4)确定固体E是否洗涤干净的方法是:取最后一次洗涤液加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净;
(5)依据实验探究1、2中现象的分析及数据计算判断出这包久置“双吸剂”固体的成分是Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验反思】下列对实验探究1、2的反思,不正确的是D(填字母序号).
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2溶液B中的溶质为Na2CO3和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加入足量稀盐酸有4个反应发生.
 如图,A、B、C、D、E分别代表氧化铁、稀盐酸、一氧化碳、碳酸钠溶液、氯化钡溶液中的一种.一定条件下相连环的物质间能发生反应,不相连环的物质间不发生反应,且B的相对分子质量小于D.请填空:
如图,A、B、C、D、E分别代表氧化铁、稀盐酸、一氧化碳、碳酸钠溶液、氯化钡溶液中的一种.一定条件下相连环的物质间能发生反应,不相连环的物质间不发生反应,且B的相对分子质量小于D.请填空: