题目内容
9.过氧化钙晶体(CaO2•8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒,以贝壳为原料制备CaO2流程如下:
(1)气体X是CO2,其固态常用于人工降雨等,将过氧化钙晶体与溶液分离的方法是过滤.
(2)反应Y需控制温度在0~5℃,可将反应容器放在冰水混合物中,该反应是化合反应,反应产物是CaO2•8H2O,请写出化学方程式CaO+7H2O+H2O2=CaO2•8H2O.获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水.
(3)为测定制得的过氧化钙晶体中CaO2•8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2•8H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g样品中CaO2•8H2O的质量分数为86.4%.
分析 (1)气体X是CO2,其固态常用于人工降雨、制造舞台云雾等;
将过氧化钙晶体与溶液分离的方法是过滤;
(2)冰水混合物的温度是0℃;
根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
氧化钙能和水反应生成氢氧化钙,氢氧化钙微溶于水;
(3)根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)气体X是CO2,其固态常用于人工降雨,制造舞台云雾等,将过氧化钙晶体与溶液分离的方法是过滤.
故填:人工降雨等;过滤.
(2)反应Y需控制温度在0~5℃,可将反应容器放在冰水混合物中;
氧化钙和水、过氧化氢反应生成过氧化钙晶体,反应的化学方程式为:CaO+7H2O+H2O2=CaO2•8H2O;
过氧化钙晶体中常含有Ca(OH)2杂质,原因是氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水.
故填:冰水混合物;CaO+7H2O+H2O2=CaO2•8H2O;氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水.
(3)设样品中过氧化钙晶体的质量为x,
2CaO2•8H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaO+O2↑+16H2O↑,
432 32
x 3.2g
$\frac{432}{x}$=$\frac{32}{3.2g}$,
x=43.2g,
样品中CaO2•8H2O的质量分数为:$\frac{43.2g}{50g}$×100%=86.4%,
故填:86.4%.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
19.下列用化学知识解释的事例正确的是( )
| A. | 空气中的铁比铝更易锈蚀,是因为铁比铝的金属活动性更强 | |
| B. | 生活中用活性炭净化水,是因为活性炭有杀菌作用 | |
| C. | 煤粉碎后燃烧更彻底,是因为粉碎后降低了煤的着火点 | |
| D. | 石灰水能使酚酞试液变红,是因为溶液里含有OH- |
20.已知MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2X+Cl2↑,则X的化学式为( )
| A. | H2 | B. | O2 | C. | H2O | D. | H2O2 |
14.锶元素的粒子结构示意图和在元素周期表中显示的信息如图所示,下列说法错误的是( )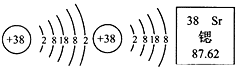

| A. | 锶的相对原子质量为87.62g | B. | 锶原子核外共有38个电子 | ||
| C. | 锶元素属于金属元素 | D. | 硫酸锶的化学式可表示为SrSO4 |




 MnSO4在工业中有重要应用,可用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4.
MnSO4在工业中有重要应用,可用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4.