题目内容
15.高温煅烧石灰石,其主要成分是碳酸钙(CaCO3),可制得生石灰(CaO),其反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2?.将500吨含杂质的石灰石样品高温煅烧,至质量不再减少为止,得剩余固体324吨,则:(1)根据质量守恒定律可知,该过程中产生二氧化碳176吨.
(2)求原石灰石样品中碳酸钙的质量分数是多少?
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳和对应的化学方程式求算碳酸钙的质量,进而求算对应的质量分数.
解答 解:(1)根据质量守恒定律,二氧化碳的质量为:500tg-324t=176t;
(2)设该石灰石样品中碳酸钙的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 44
x 176t
$\frac{100}{44}$=$\frac{x}{176t}$
x=400t
原石灰石样品中碳酸钙的质量分数为$\frac{400t}{500t}$×100%=80%
答:(1)根据质量守恒定律可知,该过程中产生二氧化碳 176吨.
(2)原石灰石样品中碳酸钙的质量分数是80%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
3.在以下几种化合物中铁元素的质量分数最高是( )
| A. | FeO | B. | Fe3O4 | C. | Fe2O3 | D. | FeS |
4.如图有关实验操作、实验现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 氢氧化钙溶液与稀盐酸混合 | 有气泡产生 | 氢氧化钙与盐酸反应 |
| B | 铜丝浸入硫酸锌溶液中 | 无现象 | 铜与硫酸锌反 应 |
| C | 某溶液中加入Ba(NO3)2溶液和稀硫酸 | 有白色沉淀产生 | 原溶液中一定含SO42- |
| D | 往硫酸铜溶液中滴加氢氧化钾溶液 | 生成蓝色沉淀 | 发生了化学反应 |
| A. | A | B. | B | C. | C | D. | D |
5.正确的化验操作对验结果、人身安全重要.图中的验操正的是( )
| A. |  闻气体气味 | B. |  取用块状固体 | C. |  滴加液体 | D. |  稀释浓硫酸 |
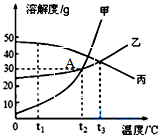 甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题.
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题.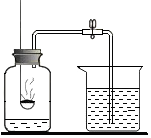 在化学课上同学们用如图所示装置来测定空气里氧气的含量.实验步骤如下:先用弹簧夹夹住乳胶管,再点燃红磷,伸入瓶中,并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹.请你根据实验,回答下列问题.
在化学课上同学们用如图所示装置来测定空气里氧气的含量.实验步骤如下:先用弹簧夹夹住乳胶管,再点燃红磷,伸入瓶中,并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹.请你根据实验,回答下列问题.