题目内容
活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品.用粗ZnO制备活性ZnO的生产工艺流程做如图所示.
I制备活性氧化锌一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图: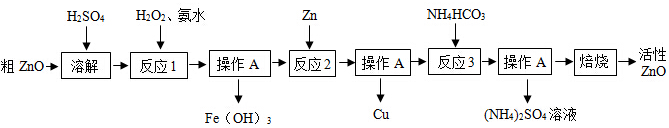
【查阅资料】
(1)粗ZnO中常含杂质FeO、CuO
(2)反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
(3)已知:几种物质沉淀时的pH如表:
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是 .
(2)写出ZnO与加稀硫酸反应的化学方程式
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是 ,操作A的名称是 .
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型).
II测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3?yZn(OH)2?zH2O,用下列装置测定碱式碳酸锌的化学组成.(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3?yZn(OH)2?zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3
ZnO+CO2↑ Zn(OH)2
ZnO+H2O
【实验步骤】
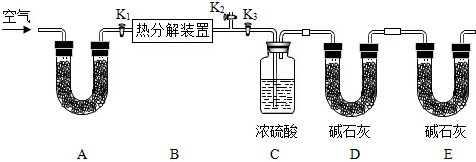
①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,打启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如表数据:
【实验分析及数据处理】
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 .
(2)第⑤步继续通空气的目的是 .
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”).
(4)根据上述数据,计算xZnCO3?yZn(OH)2?zH2O中x:y:z的最简比= 该碱式碳酸锌受热分解的化学方程式为 .
I制备活性氧化锌一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图:

【查阅资料】
(1)粗ZnO中常含杂质FeO、CuO
(2)反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
(3)已知:几种物质沉淀时的pH如表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是
(2)写出ZnO与加稀硫酸反应的化学方程式
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是
(4)反应2中加入锌发生的反应属于
II测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3?yZn(OH)2?zH2O,用下列装置测定碱式碳酸锌的化学组成.(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3?yZn(OH)2?zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3
| ||
| ||
【实验步骤】

①按图连接好装置,并检查装置的
②在热分解装置中装入68.2g样品,打开活塞
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,打启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如表数据:
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是
(2)第⑤步继续通空气的目的是
(3)E处碱石灰的作用是
(4)根据上述数据,计算xZnCO3?yZn(OH)2?zH2O中x:y:z的最简比=
考点:物质的相互转化和制备,过滤的原理、方法及其应用,气体的净化(除杂),酸的化学性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:物质的制备
分析:【问题讨论】
(1)将洗净的石英砂研磨成粉末是增大接触面积,加快反应速率,提高生产效率;
(2)根据氧化锌和稀硫酸反应生成硫酸锌和水及质量守恒定律解答;
(3)根据氢氧化铁沉淀时的pH、Zn(OH)2和Cu(OH)2沉淀时的pH、过滤基本操作分析解答;
(4)根据置换反应的定义分析;
【实验步骤】①根据实验前先检查装置气密性解答;②先在干燥的空气流中加热分解碱式碳酸锌
【实验分析及数据处理】
(1)根据碱石灰(CaO与NaOH的固体混合物)既能吸水,氢氧化钠能和二氧化碳反应分析;
(2)根据这样做能使反应生成的二氧化碳和水蒸气被完全吸收分析解答;
(3)根据E能吸收空气中的水和二氧化碳解答;
(4)根据C吸收的是水,D吸收的是二氧化碳,碱式碳酸锌样品22.6g,反应前C装置的质量为198.4g,反应后质量为209.2g,故生成水的质量为209.2g-198.4g=1.8g;反应前D装置的质量为235.7g,反应后质量为244.5g,生成二氧化碳的质量为8.8g,故氧化锌的质量为22.6g-1.8g-8.8g=12g,计算各物质的物质的量,利用元素守恒计算碱式碳酸锌中x、y、z,据此书写碱式碳酸锌化学式.
(1)将洗净的石英砂研磨成粉末是增大接触面积,加快反应速率,提高生产效率;
(2)根据氧化锌和稀硫酸反应生成硫酸锌和水及质量守恒定律解答;
(3)根据氢氧化铁沉淀时的pH、Zn(OH)2和Cu(OH)2沉淀时的pH、过滤基本操作分析解答;
(4)根据置换反应的定义分析;
【实验步骤】①根据实验前先检查装置气密性解答;②先在干燥的空气流中加热分解碱式碳酸锌
【实验分析及数据处理】
(1)根据碱石灰(CaO与NaOH的固体混合物)既能吸水,氢氧化钠能和二氧化碳反应分析;
(2)根据这样做能使反应生成的二氧化碳和水蒸气被完全吸收分析解答;
(3)根据E能吸收空气中的水和二氧化碳解答;
(4)根据C吸收的是水,D吸收的是二氧化碳,碱式碳酸锌样品22.6g,反应前C装置的质量为198.4g,反应后质量为209.2g,故生成水的质量为209.2g-198.4g=1.8g;反应前D装置的质量为235.7g,反应后质量为244.5g,生成二氧化碳的质量为8.8g,故氧化锌的质量为22.6g-1.8g-8.8g=12g,计算各物质的物质的量,利用元素守恒计算碱式碳酸锌中x、y、z,据此书写碱式碳酸锌化学式.
解答:【问题讨论】
(1)要将洗净的石英砂研磨成粉末是增大接触面积,加快反应速率,提高生产效率;故答案:使氧化锌粗品充分反应.(只答提高反应速度不给分)
(2)氧化锌和稀硫酸反应生成硫酸锌和水,反应的化学方程式为ZnO+H2SO4=ZnSO4+H2O,故答案:ZnO+H2SO4=ZnSO4+H2O;
(3)氢氧化铁沉淀时的pH是1.48~3.2,Zn(OH)2沉淀时的pH为6.2~8.0;和Cu(OH)2沉淀时的pH为5.2~6.4;过滤就能得到氢氧化铁沉淀,故答案:分别为3.2~5.2;过滤;
(4)反应2是锌和硫酸铜反应生成铜和硫酸锌,是一种单质和一中化合物反应生成另一种单质和另一种化合物,属置换反应,故答案:置换;
II测定碱式碳酸锌的化学式
①实验前要检查装置气密性,故答案:气密性
②打开活塞K1、K2,关闭 K3
【实验分析及数据处理】
(1)碱石灰的作用除去鼓入空气中的二氧化碳和水蒸气,故答案:除去鼓入空气中的二氧化碳和水蒸气;
(2)继续通空气的目的是使反应生成的二氧化碳和水蒸气被完全吸收,故答案:使反应生成的二氧化碳和水蒸气被完全吸收;
(3)E处碱石灰的作用是防止空气中的二氧化碳和水蒸气进入装置D,那么装置D吸收了一部分空气中的二氧化碳,增重大于实际分解得到的二氧化碳,使实验结果偏大;故答案:防止空气中的二氧化碳和水蒸气进入装置D;偏大;
(4)碱式碳酸锌样品22.6g,反应前C装置的质量为198.4g,反应后质量为209.2g,故生成水的质量为209.2g-198.4g=10.8g;反应前D装置的质量为235.7g,反应后质量为244.5g,生成二氧化碳的质量为8.8g,故氧化锌的质量为22.6g-1.8g-8.8g=12g,故
xZn CO3?yZn(OH)2?zH2O
(x+y)ZnO+(y+z)H2O+xCO2
81(x+y) 18(y+z) 44x
12g 10.8g 8.8g
则x:y:z的最简比=1:2:1;反应的化学方程式方程式为ZnCO3?2Zn(OH)2?H2O=3ZnO+CO2↑+2H2O.
(1)要将洗净的石英砂研磨成粉末是增大接触面积,加快反应速率,提高生产效率;故答案:使氧化锌粗品充分反应.(只答提高反应速度不给分)
(2)氧化锌和稀硫酸反应生成硫酸锌和水,反应的化学方程式为ZnO+H2SO4=ZnSO4+H2O,故答案:ZnO+H2SO4=ZnSO4+H2O;
(3)氢氧化铁沉淀时的pH是1.48~3.2,Zn(OH)2沉淀时的pH为6.2~8.0;和Cu(OH)2沉淀时的pH为5.2~6.4;过滤就能得到氢氧化铁沉淀,故答案:分别为3.2~5.2;过滤;
(4)反应2是锌和硫酸铜反应生成铜和硫酸锌,是一种单质和一中化合物反应生成另一种单质和另一种化合物,属置换反应,故答案:置换;
II测定碱式碳酸锌的化学式
①实验前要检查装置气密性,故答案:气密性
②打开活塞K1、K2,关闭 K3
【实验分析及数据处理】
(1)碱石灰的作用除去鼓入空气中的二氧化碳和水蒸气,故答案:除去鼓入空气中的二氧化碳和水蒸气;
(2)继续通空气的目的是使反应生成的二氧化碳和水蒸气被完全吸收,故答案:使反应生成的二氧化碳和水蒸气被完全吸收;
(3)E处碱石灰的作用是防止空气中的二氧化碳和水蒸气进入装置D,那么装置D吸收了一部分空气中的二氧化碳,增重大于实际分解得到的二氧化碳,使实验结果偏大;故答案:防止空气中的二氧化碳和水蒸气进入装置D;偏大;
(4)碱式碳酸锌样品22.6g,反应前C装置的质量为198.4g,反应后质量为209.2g,故生成水的质量为209.2g-198.4g=10.8g;反应前D装置的质量为235.7g,反应后质量为244.5g,生成二氧化碳的质量为8.8g,故氧化锌的质量为22.6g-1.8g-8.8g=12g,故
xZn CO3?yZn(OH)2?zH2O
| ||
81(x+y) 18(y+z) 44x
12g 10.8g 8.8g
则x:y:z的最简比=1:2:1;反应的化学方程式方程式为ZnCO3?2Zn(OH)2?H2O=3ZnO+CO2↑+2H2O.
点评:考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.

练习册系列答案
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
下列物质是由分子构成的单质的是( )
| A、二氧化碳 | B、铝 | C、氮气 | D、水 |
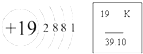 如图是某原子的结构示意图和它在元素周期表中的部分信息,该元素的名称是
如图是某原子的结构示意图和它在元素周期表中的部分信息,该元素的名称是 如图是某反应的微观示意图,若
如图是某反应的微观示意图,若  表示氧原子,
表示氧原子, 表示氢原子,从微观示意图中,你能得出的结论有:(写两条即可)
表示氢原子,从微观示意图中,你能得出的结论有:(写两条即可)