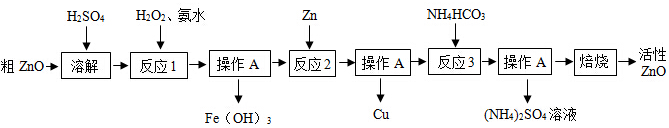
题目内容
在-次课外活动中,先后有三组同学对含有碳酸钠的氯化钠样品进行了如下实验.
实验老师提供的试剂有:①盐酸 ②氯化钙溶液 ③氢氧化钠溶液④硝酸钙溶液
(1)为了得到纯净的氯化钠溶液,第一组同学取一定量的上述固体混合物,全部溶解于水.
然后加入所选试剂,恰好完全反应后过滤,所得滤液为氯化钠溶液.则该组同学选择的试剂是 (填写所选试剂的编号).
(2)为了测定该固体混合物中氯化钠的质量分数,第二组同学取该固体混合物26.5g,全部溶解于水,然后加入另一种试剂至刚好完全反应,生产气体质量为2.2克.该固体混合物中氯化钠的质量分数是多少?
(3)为了测定该样品中氯化钠的质量分数,第三组同学将取该固体混合物53g全部溶解于水,然后加入和第一组同学一样的试剂,刚好完全反应,然后过滤,得到干燥滤渣的质量为10g,将滤液进行蒸发得到氯化钠的晶体质量为54.1g,所以算出氯化钠的质量分数为:(54.1g÷53g)×100%=102.1%,这组同学的结果是明显是错误,请指出他们错误的原因 应该怎样才能计算出该固体混合物的氯化钠的质量分数?请把计算过程列出来.
实验老师提供的试剂有:①盐酸 ②氯化钙溶液 ③氢氧化钠溶液④硝酸钙溶液
(1)为了得到纯净的氯化钠溶液,第一组同学取一定量的上述固体混合物,全部溶解于水.
然后加入所选试剂,恰好完全反应后过滤,所得滤液为氯化钠溶液.则该组同学选择的试剂是
(2)为了测定该固体混合物中氯化钠的质量分数,第二组同学取该固体混合物26.5g,全部溶解于水,然后加入另一种试剂至刚好完全反应,生产气体质量为2.2克.该固体混合物中氯化钠的质量分数是多少?
(3)为了测定该样品中氯化钠的质量分数,第三组同学将取该固体混合物53g全部溶解于水,然后加入和第一组同学一样的试剂,刚好完全反应,然后过滤,得到干燥滤渣的质量为10g,将滤液进行蒸发得到氯化钠的晶体质量为54.1g,所以算出氯化钠的质量分数为:(54.1g÷53g)×100%=102.1%,这组同学的结果是明显是错误,请指出他们错误的原因
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)要得到纯净的氯化钠溶液,所选的试剂应该不与氯化钠反应,且与碳酸钠反应有沉淀生成,据此答题;
(2)由题意可知,加入另一种所选试剂,生成气体,故可判断所选试剂是盐酸.根据盐酸与碳酸钠反应的化学方程式和生成气体的质量,就可计算出原混合物中Na2CO3的质量,然后根据质量分数公式“
”计算即可.
(3)加入氯化钙溶液与碳酸钠反应生成了氯化钠,所以蒸发滤液所得氯化钠质量实际上是原混合物中的氯化钠和反应生成的氯化钠的质量总和.
应根据碳酸钠与氯化钙反应的化学方程式结合生成沉淀的质量计算出原混合物中Na2CO3的质量,然后根据质量分数公式“
”计算即可.
(2)由题意可知,加入另一种所选试剂,生成气体,故可判断所选试剂是盐酸.根据盐酸与碳酸钠反应的化学方程式和生成气体的质量,就可计算出原混合物中Na2CO3的质量,然后根据质量分数公式“
| 混合物的质量-原混合物中碳酸钠的质量 |
| 混合物的质量 |
(3)加入氯化钙溶液与碳酸钠反应生成了氯化钠,所以蒸发滤液所得氯化钠质量实际上是原混合物中的氯化钠和反应生成的氯化钠的质量总和.
应根据碳酸钠与氯化钙反应的化学方程式结合生成沉淀的质量计算出原混合物中Na2CO3的质量,然后根据质量分数公式“
| 混合物的质量-原混合物中碳酸钠的质量 |
| 混合物的质量 |
解答:解:(1)①盐酸不与氯化钠反应,但与碳酸钠反应没有沉淀生成,故①不适合;
②氯化钙溶液不与氯化钠反应,与碳酸钠反应生成碳酸钙沉淀,故②适合;
③氢氧化钡溶液既可与氯化钠反应,也可与碳酸钠反应生成碳酸钡沉淀,溶液中就不存在氯化钠,故③不适合;
故选:②.
(2)解:设原混合物中Na2CO3的质量为x,
Na2CO3十2HCl=2NaCl十H2O十CO2↑
106 44
X 2.2g
∴
=
解之得:x=5.3g,
原混合物中氯化钠的质量分数为:
×100%=80%.
答:该固体混合物中碳酸钠的质量分数为20%.
(3)加入氯化钙溶液与碳酸钠反应生成了氯化钠,所以蒸发滤液所得氯化钠质量实际上是原混合物中的氯化钠和反应生成的氯化钠的质量总和.
设碳酸钠的质量为Y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
Y 10g
Y=10.6 g
原混合物中氯化钠的质量分数为:
×100%=80%
答:原混合物中氯化钠的质量分数是80%.
②氯化钙溶液不与氯化钠反应,与碳酸钠反应生成碳酸钙沉淀,故②适合;
③氢氧化钡溶液既可与氯化钠反应,也可与碳酸钠反应生成碳酸钡沉淀,溶液中就不存在氯化钠,故③不适合;
故选:②.
(2)解:设原混合物中Na2CO3的质量为x,
Na2CO3十2HCl=2NaCl十H2O十CO2↑
106 44
X 2.2g
∴
| 106 |
| x |
| 44 |
| 2.2g |
解之得:x=5.3g,
原混合物中氯化钠的质量分数为:
| 26.5g-5.3g |
| 26.5g |
答:该固体混合物中碳酸钠的质量分数为20%.
(3)加入氯化钙溶液与碳酸钠反应生成了氯化钠,所以蒸发滤液所得氯化钠质量实际上是原混合物中的氯化钠和反应生成的氯化钠的质量总和.
设碳酸钠的质量为Y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
Y 10g
Y=10.6 g
原混合物中氯化钠的质量分数为:
| (53g-10.6g) |
| 53g |
答:原混合物中氯化钠的质量分数是80%.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目
 元素周期表是学习化学的重要工具,如图是元素周期表中的一格.从该图中,获取的下列信息中错误的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格.从该图中,获取的下列信息中错误的是( )| A、该元素的名称是镁 |
| B、该元素的原子序数是12 |
| C、该元素的原子核内有12个质子 |
| D、该元素原子的质量是24.31g |
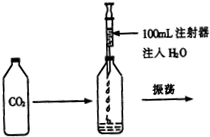 校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验.请你根据生活经验及所学的知识,结合实验回答下列问题:
校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验.请你根据生活经验及所学的知识,结合实验回答下列问题: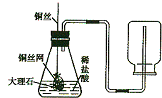 李丽同学设计了实验室制取CO2装置(如图所示),装置中出现了一个错误,你的纠正方法是
李丽同学设计了实验室制取CO2装置(如图所示),装置中出现了一个错误,你的纠正方法是