题目内容
中国登山队成功登上珠峰峰顶,圆满完成珠峰高度重新测量工作.登山队员常用的能源可由氢化钙固体提供,它能和水反应产生氢氧化钙和氢气.
(1)氢化钙与水反应的化学方程式为 .
(2)若登山队需要60g氢气,需要含CaH295%的氢化钙固体能源多少克?(杂质不参加反应)
(1)氢化钙与水反应的化学方程式为
(2)若登山队需要60g氢气,需要含CaH295%的氢化钙固体能源多少克?(杂质不参加反应)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据题中的叙述找出反应物、生成物书写方程式;
(2)首先列出方程式,根据题中的数据,列出比例关系进行求解.
(2)首先列出方程式,根据题中的数据,列出比例关系进行求解.
解答:解:
(1)氢化钙和水反应生成氢氧化钙和氢气,故答案为:CaH2+2H2O=2H2↑+Ca(OH)2;
(2)需要含CaH295%的氢化钙固体的质量为x
CaH2+2H2O═2H2↑+Ca(OH)2
42 4
95%x 60g
=
x=821.1g
答案:
(1)CaH2+2H2O=2H2↑+Ca(OH)2
(2)需要含CaH295%的氢化钙固体能源821.1克
(1)氢化钙和水反应生成氢氧化钙和氢气,故答案为:CaH2+2H2O=2H2↑+Ca(OH)2;
(2)需要含CaH295%的氢化钙固体的质量为x
CaH2+2H2O═2H2↑+Ca(OH)2
42 4
95%x 60g
| 42 |
| 4 |
| 95%x |
| 60g |
x=821.1g
答案:
(1)CaH2+2H2O=2H2↑+Ca(OH)2
(2)需要含CaH295%的氢化钙固体能源821.1克
点评:在解此类题时,首先根据题中的叙述书写方程式,然后根据方程式中的等量关系进行求解,需要注意代入方程式中的都是纯净物的质量.

练习册系列答案
相关题目





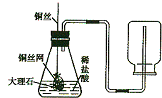 李丽同学设计了实验室制取CO2装置(如图所示),装置中出现了一个错误,你的纠正方法是
李丽同学设计了实验室制取CO2装置(如图所示),装置中出现了一个错误,你的纠正方法是 元素周期表是学习化学的重要工具,从中可以获取许多信息.如图是元素周期表的一部分,从中可了解到硒元素的原子核的质子数为
元素周期表是学习化学的重要工具,从中可以获取许多信息.如图是元素周期表的一部分,从中可了解到硒元素的原子核的质子数为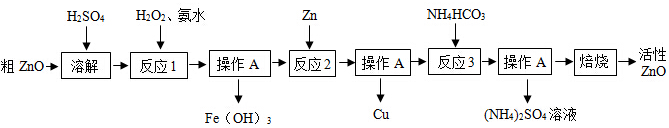
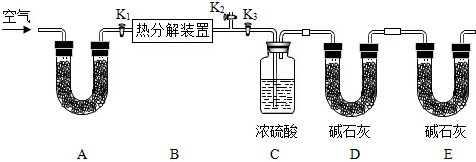

 镁带在氧气中完全燃烧后生成氧化镁,其固体质量变化可用图表示,则:M2与M1质量差表示的质量是
镁带在氧气中完全燃烧后生成氧化镁,其固体质量变化可用图表示,则:M2与M1质量差表示的质量是