题目内容
13.有①氢气②二氧化锰③氯化钠④自来水四种物质,请用序号填空:(1)属于混合物的有:④
(2)属于单质的是:①
(3)属于化合物的有:②③
(4)属于氧化物的有:②.
分析 纯净物由一种物质组成,混合物由两种或两种以上的物质组成;
单质是由一种元素组成的纯净物,化合物是由不同种元素组成的纯净物;
氧化物是由氧元素和另外一种元素组成的化合物.
解答 解:(1)自来水中含有水和一些溶于水的物质,属于混合物;
(2)氢气是由一种元素组成的纯净物,属于单质;
(3)二氧化锰和氯化钠都是由不同种元素组成的纯净物,都属于化合物;
(4)二氧化锰是由锰元素和氧元素组成的化合物,属于氧化物.
故填:④;①;②③;②.
点评 判断纯净物和混合物时,就是判断物质的物质组成;判断是否是单质、化合物、氧化物时,既要判断元素组成,又要判断物质组成.

练习册系列答案
相关题目
3.某化学反应可以用下列微观示意图表示,有关说法正确的是( )


| A. | 该反应前后所有元素的化合价都没有变化 | |
| B. | 该反应涉及2种化合物、1种单质 | |
| C. | 该反应涉及到四种原子 | |
| D. | 示意图中虚线框内的原子应该是“○” |
4.某同学用量筒量取30mL水时仰视,然后俯视倒出一部分水至20mL,则倒出的水的体积( )
| A. | 等于10mL | B. | 大于10mL | C. | 小于10mL | D. | 无法确定 |
1.镁带在空气中充分燃烧,在该反应中,镁、氧气、氧化镁的质量比为( )
| A. | 2:1:2 | B. | 24:32:40 | C. | 48:32:80 | D. | 48:16:64 |
18.从水分子分解示意图中我们能获得许多信息,其中描述正确的是( )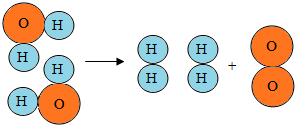

| A. | 这是一个化合反应 | |
| B. | 在化学变化中氢原子和氧原子是最小的粒子 | |
| C. | 水是由氢气和氧气组成的 | |
| D. | 在化学变化中氢分子和氧分子都没有发生变化 |
5.一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某化学兴趣小组对此产生了兴趣,开展了如下探究.
查阅资料:“污渍爆炸盐”的主要成分是过碳酸钠(化学式为Na2CO4),它是一种白色固体粉末,易溶于水且能与水反应生成甲和乙两种化合物,其中化合物乙有强氧化性,具有较好的去污效果.碳酸钠常温或加热不分解.
(1)小明同学对化合物乙的强氧化性产生兴趣,为了探究它的成分,做了如下实验设计,请你和他一起探究,完成下面问题.
(2)小明同学认为生成的化合物甲可能是碳酸钙(CaCO3),小亮同学认为可能是碳酸钠(Na2CO3)你支持小亮同学的观点,你的理由是反应物中不含有钙元素,因此不可能生成碳酸钙.
(3)小磊同学将“污渍爆炸盐”放入冷水中,发现产生少量气泡;而放入热水中,产生较多气泡,由此你认为影响化合物乙分解快慢的因素是温度.测得分解快慢的方法有很多,请你再说出一种测定的实验方法(用简洁的文字表述):把相同质量的“污渍爆炸盐”同时分别置于盛有相同体积的冷水和热水的试管中,同时利用相同体积的集气瓶用排水法收集气体,置于热水中的集气瓶收集满气体需要的时间短,说明温度越高,化合物乙分解的越快.
(4)影响化合物乙分解快慢的因素还有哪些?请你提出一个猜想,并设计实验方案验证你的猜想.
猜想:化合物乙的浓度影响乙的分解速率.
实验方案:实验步骤:把相同质量的“污渍爆炸盐”同时分别置于盛有不同体积热水的试管中,同时利用相同体积的集气瓶用排水法收集气体;
实验现象及其实验结论:水的体积小的集气瓶收集满气体需要的时间短,说明乙的浓度越大,化合物乙分解的越快.
查阅资料:“污渍爆炸盐”的主要成分是过碳酸钠(化学式为Na2CO4),它是一种白色固体粉末,易溶于水且能与水反应生成甲和乙两种化合物,其中化合物乙有强氧化性,具有较好的去污效果.碳酸钠常温或加热不分解.
(1)小明同学对化合物乙的强氧化性产生兴趣,为了探究它的成分,做了如下实验设计,请你和他一起探究,完成下面问题.
| 序号 | 实验步骤 | 实验现象 | 实验结论与解释 |
| 1 | 取少量“污渍爆炸盐”于试管中,加入适量的水 | 固体溶解 | 该固体易溶于水且能与水反应 |
| 2 | 向1中所得的液体中加入适量的二氧化锰 | 产生大量气泡 | 试管中产生的气体是 O2(填化学式,下同),过碳酸钠和水反应生成的化合物乙是 H2O2 |
| 3 | 将带火星的小木条放在试管中,观察现象 | 木条复燃 |
(3)小磊同学将“污渍爆炸盐”放入冷水中,发现产生少量气泡;而放入热水中,产生较多气泡,由此你认为影响化合物乙分解快慢的因素是温度.测得分解快慢的方法有很多,请你再说出一种测定的实验方法(用简洁的文字表述):把相同质量的“污渍爆炸盐”同时分别置于盛有相同体积的冷水和热水的试管中,同时利用相同体积的集气瓶用排水法收集气体,置于热水中的集气瓶收集满气体需要的时间短,说明温度越高,化合物乙分解的越快.
(4)影响化合物乙分解快慢的因素还有哪些?请你提出一个猜想,并设计实验方案验证你的猜想.
猜想:化合物乙的浓度影响乙的分解速率.
实验方案:实验步骤:把相同质量的“污渍爆炸盐”同时分别置于盛有不同体积热水的试管中,同时利用相同体积的集气瓶用排水法收集气体;
实验现象及其实验结论:水的体积小的集气瓶收集满气体需要的时间短,说明乙的浓度越大,化合物乙分解的越快.
2.某兴趣小组对氢氧化钠固体暴露在空气中的变质情况进行了研究.把一小块固体氢氧化钠放在表面皿里,长时间暴露在空气中,发现其固体表面逐渐湿润,部分溶化成液体.请回答兴趣小组产生的下列问题:
(1)实验室中,氢氧化钠固体应该密封保存
(2)氢氧化钠固体暴露在空气中,表面逐渐湿润,是因为氢氧化钠吸收了空气中的水蒸气.
(3)兴趣小组进一步对氢氧化钠是否变质?变质的程度进行了探究,做了以下验:
(4)请同学们写出氢氧化钠变质的反应原理(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O
(5)如果需要配制溶质质量分数为25%的氢氧化钠溶液240g,需要称量氢氧化钠固体60g,量取水180mL.(水的密度为1g/mL)
(1)实验室中,氢氧化钠固体应该密封保存
(2)氢氧化钠固体暴露在空气中,表面逐渐湿润,是因为氢氧化钠吸收了空气中的水蒸气.
(3)兴趣小组进一步对氢氧化钠是否变质?变质的程度进行了探究,做了以下验:
| 实验步骤 | 实验现象 | 实验结论 |
| 1、取少量待测试液于试管中,向其滴加足量的稀盐酸 | 有气泡冒出. | 氢氧化钠已经变质 |
| 2、取少待测试液于另一试管中,加足量氯化钙溶液 或足量的氯化钡溶液,过滤,再在滤液中滴加酚酞 试液. | 有白色沉淀生成,加入某试液后滤液变红色. | 氢氧化钠部分变质. |
(5)如果需要配制溶质质量分数为25%的氢氧化钠溶液240g,需要称量氢氧化钠固体60g,量取水180mL.(水的密度为1g/mL)
3.20℃时,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,有关说法不正确的是( )
| 物质 | 甲 | 乙 | 丙 |
| 未溶解固体的质量/g | 7 | 0 | 3 |
| A. | 所得溶液可能都是饱和溶液 | |
| B. | 升高温度,三溶液都一定会变成不饱和溶液 | |
| C. | 三溶液中溶质溶解的质量乙>丙>甲 | |
| D. | 降温或蒸发溶剂都可能让乙形成的溶液中析出晶体 |