题目内容
18.利用纳米二氧化钛(TiO2)可净化室内空气.TiO2中Ti的化合价为( )| A. | +4 | B. | +2 | C. | +1 | D. | -4 |
分析 根据在化合物中正负化合价代数和为零,结合二氧化钛(TiO2)的化学式进行解答本题.
解答 解:根据在化合物中正负化合价代数和为零,氧元素显-2,设钛元素的化合价为x,可知二氧化钛(TiO2)中钛元素的化合价:x+(-2)×2=0,则x=+4.
故选A.
点评 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列实验操作规范的是( )
| A. | 将PH试纸浸入苹果汁中,测定苹果汁的PH | |
| B. | 将氯化铵溶液滴入酚酞试液中,检验氯化铵溶液的酸碱性 | |
| C. | 将湿润的石蕊试纸沾在玻璃棒上接近SO2,试验气体的性质 | |
| D. | 用玻璃棒蘸取盐酸沾在pH试纸上,观察试纸的颜色变化,测得盐酸的pH |
6.埃博拉病毒是当今世界上最凶险的病毒之一,其致死率可高达90%,日本最近研制出抗击埃博拉病毒的药物Favipiravir,其化学式为C5H4N3O2F,下列有关这种药物的说法错误的是( )
| A. | 它由五种元素组成 | B. | 它的分子中氢、氧原子个数比为2:1 | ||
| C. | 该药物由15个原子构成 | D. | 该药物中碳元素的质量分数最大 |
10.下列关于相应微粒的描述中,不正确的是( )
| A. |  化学性质稳定 | B. |  易形成阴离子 | C. |  带正电荷 | D. |  易失电子 |
7.正确观察和描述实验现象是学好化学的因素之一,下列说法中不正确的是( )
| A. | 镁条在空气中燃烧,发出耀眼的白光 | |
| B. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰 | |
| C. | 一氧化碳在在空气中燃烧发出淡蓝色火焰 | |
| D. | 细铁丝在氧气中燃烧,火星四射,有黑色固体生成 |
8. 请完成下列相关内容:
请完成下列相关内容:
Ⅰ.实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的.
(1)铁在潮湿的空气中易生锈,铁锈的主要成分为Fe2O3•ⅹH2O(或Fe2O3);铁在氧气中能剧烈燃
烧,现象为剧烈燃烧,火星四射,有黑色固体生成,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)铜在潮湿的空气中也容易锈蚀生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],铜锈蚀除了与氧气有关外,还与空气中的水和二氧化碳有关.
(3)铝在空气中具有很好的抗腐蚀性能,其原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
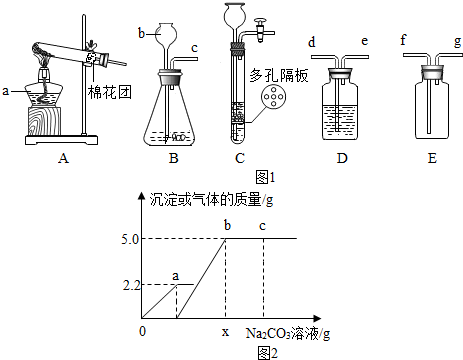
Ⅱ.过氧化钠(Na2O2)是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分.
【提出问题】变质的过氧化钠粉末中有哪些成分?
【查阅资料】2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2CO2═2Na2CO3+O2
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【实验探究】
【得出结论】同学们经过实验和计算分析,该固体样品中所含物质有Na2O2、NaOH和Na2CO3.
【拓展应用】过氧化钠(Na2O2)是供氧设备中常用的供氧剂.若将15.6g过氧化钠与足量的二氧化碳充分反应,理论上生成的氧气质量是多少?(写出计算过程).
 请完成下列相关内容:
请完成下列相关内容:Ⅰ.实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的.
(1)铁在潮湿的空气中易生锈,铁锈的主要成分为Fe2O3•ⅹH2O(或Fe2O3);铁在氧气中能剧烈燃
烧,现象为剧烈燃烧,火星四射,有黑色固体生成,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)铜在潮湿的空气中也容易锈蚀生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],铜锈蚀除了与氧气有关外,还与空气中的水和二氧化碳有关.
(3)铝在空气中具有很好的抗腐蚀性能,其原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
Ⅱ.过氧化钠(Na2O2)是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分.
【提出问题】变质的过氧化钠粉末中有哪些成分?
【查阅资料】2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2CO2═2Na2CO3+O2
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取3.00g变质粉末于一支大试管中,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解, 带火星的木条复燃 | 该固体样品中含有Na2O2,其质量为1.56g. |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀 | 化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. | / | / |
【拓展应用】过氧化钠(Na2O2)是供氧设备中常用的供氧剂.若将15.6g过氧化钠与足量的二氧化碳充分反应,理论上生成的氧气质量是多少?(写出计算过程).
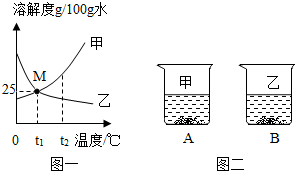 图一为甲、乙两种物质(不带结晶水)的溶解度曲线图.
图一为甲、乙两种物质(不带结晶水)的溶解度曲线图.