题目内容
5.下表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题: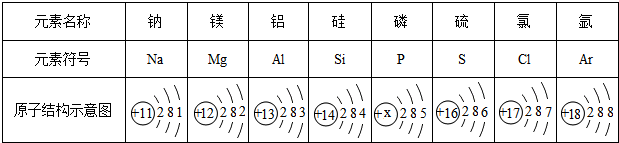
(1)表中硫原子的核电荷数x=16;
(2)表中具有相对稳定结构的元素是Ar;
(3)在化学反应中,每个镁原子失去2个电子形成镁离子;
(4)铝元素与氯元素形成的化合物化学式为AlCl3;
(5)上述元素在周期表中处于同一周期的原因是具有相同的电子层数.
分析 (1)根据核电荷数与核外电子数的关系进行分析;
(2)根据相对稳定结构与最外层电子数关系进行分析;
(3)根据镁原子最外层电子数为2进行解答;
(4)根据化合价写出化学式;
(5)根据元素周期与电子层数的关系进行分析.
解答 解:(1)对于原子来说核内质子数等于核电荷数等于核外电子数,所以硫原子的核电荷数x=2+8+6=16;
(2)最外层电子数为8(一个电子层最外层是2)属于相对稳定结构,所以表中具有相对稳定结构的元素是氩元素;
(3)镁原子最外层电子数为2,所以在化学反应中,每个镁原子失去2个电子形成镁离子;
(4)铝元素最外层电子数是3容易失去3个电子带3各单位正电荷,显+3价;氯元素最外层电子数是7容易得一个电子,带1个单位负电荷,显-1价,所以正价在前,负价在后,十字交叉再约简,所以化学式是AlCl3;
(5)原子所处的周期数与该原子的电子层数相同,所以在周期表中处于同一周期的原子,核外电子层数相同.
故答案为:(1)16;
(2)Ar;
(3)2;
(4)AlCl3;
(5)具有相同的电子层数.
点评 解答本题关键是要知道核电荷数、质子数、电子数的关系,相对稳定结构的特点,化学式的写法,了解周期数等于原子核外电子层数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16. 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶中加入少量水,并做上记号.下列说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶中加入少量水,并做上记号.下列说法中不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶中加入少量水,并做上记号.下列说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶中加入少量水,并做上记号.下列说法中不正确的是( )| A. | 该实验证明空气中氧气的体积分数约为$\frac{1}{5}$ | |
| B. | 实验时红磷一定要过量 | |
| C. | 该实验证明空气中氧气的质量约占空气质量的$\frac{1}{5}$ | |
| D. | 红磷燃烧产生大量的白烟,火焰熄灭并冷却后在打开弹簧夹( 空气中氧气含量测定) |
20.除去下列物质中含有的少量杂质(括号内的物质),所选用试剂不合理的是( )
| 选项 | 物质 | 选用试剂 |
| A | CO(CO2) | 氢氧化钠溶液 |
| B | Cu(Fe) | 硫酸铜溶液 |
| C | NaOH溶液[Ca(OH)2溶液] | 碳酸钠溶液 |
| D | CaO (CaCO3) | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
17.推理是学习科学的一种重要方法,但盲目类推又得出错误结论.以下推理正确的是( )
| A. | MnO2能加快H2O2分解的速率,则MnO2也一定能加快其他物质分解的速率 | |
| B. | 在同一化合物中,金属元素显正价,所以非金属元素一定显负价 | |
| C. | 接近饱和的硝酸钾溶液可通过降温的方法变成饱和,则所有接近饱和的溶液都可通过降温的方法变成饱和溶液 | |
| D. | 含碳元素的物质充分燃烧会生成CO2,所以有机物在氧气充分燃烧 能有CO2生成 |
14.现有a、b、c三种金属,a、b分别与稀硫酸、c的硫酸盐溶液作用的现象如表所示:
根据表中所给的实验结果,判断这三种金属的活动性由强到弱的正确顺序是( )
| 与a、b作用的物质 | a | b |
| 稀硫酸 | 溶解并放出气体 | 无明显变化 |
| c的硫酸盐溶液 | 表面有c析出 | 表面有c析出 |
| A. | a、b、c | B. | c、a、b | C. | a、c、b | D. | b、c、a |
 生活离不开科学,科学与生活息息相关.
生活离不开科学,科学与生活息息相关. (1)图是某校食堂的食谱,从所含营养素分析,除水和无机盐外,主食中主要含有营养素是糖类,食谱中缺少的营养素是维生素.
(1)图是某校食堂的食谱,从所含营养素分析,除水和无机盐外,主食中主要含有营养素是糖类,食谱中缺少的营养素是维生素.