题目内容
8. 如图是某胃药标签的部分内容.小明同学测定该药品中NaHCO3含量的过程如下:去10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的PH=7时(已知药品中的其他成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g.称 得反应后烧杯内物质的总质量为64.3g.请计算:
如图是某胃药标签的部分内容.小明同学测定该药品中NaHCO3含量的过程如下:去10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的PH=7时(已知药品中的其他成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g.称 得反应后烧杯内物质的总质量为64.3g.请计算:(1)胃药中NaHCO3的质量分数.
(2)形成NaCl不饱和溶液中溶质的质量分数.
分析 (1)根据质量守恒定律计算生成二氧化碳气体的质量,根据化学方程式和生成二氧化碳的质量,计算参加反应的碳酸氢钠的质量及生成的氯化钠的质量再,即可求出胃药中NaHCO3的质量分数;
(2)依据质量守恒定律计算反应后溶液的质量,再根据氯化钠的质量和溶液的质量计算出溶质的质量分数.
解答 解:(1)依据质量守恒定律可知,生成二氧化碳的质量为:0.5g×10+50g+11.5g-64.3g=2.2g;
设药片中碳酸氢钠的质量为x,生成的氯化钠的质量为y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 2.2g
$\frac{84}{x}=\frac{58.5}{y}=\frac{44}{2.2g}$ 解得:x=4.2g y=2.925g
所以药品中碳酸氢钠的质量分数为:$\frac{4.2g}{5g}$×100%=84%;
(2)烧杯中溶液的质量为:64.3g-(5g-4.2g)=63.5g.
形成NaCl不饱和溶液中溶质的质量分数:$\frac{2.925g}{63.5g}×100%$≈4.6%
故答案为:(1)胃药中NaHCO3的质量分数84%;(3)形成NaCl不饱和溶液中溶质的质量分数是4.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
18.为除去如表所示物质中混有的少量的杂质,所用试剂与方法正确的是( )
| 物质 | 杂质 | 所用试剂、方法 | |
| A. | CO2 | HCl | 先通过氢氧化钠溶液、再通过浓硫酸 |
| B. | KCl | MnO2 | 加水溶解、过滤、蒸发结晶 |
| C. | FeSO4 溶液 | CuSO4 | 加入过量铁粉、过滤 |
| D. | NaCl溶液 | MgCl2 | 加入过量NaOH溶液、过滤 |
| A. | A | B. | B | C. | C | D. | D |
16.下列属于铜的化学性质的是( )
| A. | 导电性 | B. | 导热性 | C. | 可燃性 | D. | 延展性 |
3.物质性质决定用途,下列说法错误的是( )
| A. | 熟石灰具有碱性,和硫酸铵混合使用防止土壤酸化、板结 | |
| B. | 盐酸能与金属氧化物反应,可用于除锈 | |
| C. | 硫酸铜溶液能与铁反应,切割钢板时用于划线 | |
| D. | 镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹 |
17.生活中处处充满化学,下列各组化学知识的总结完全正确的一组是( )
| A | ①食醋清除水垢主要发生物理变化 ②馒头烤焦变黑主要发生化学变化 | B | ①硫酸铵化肥不能与碱性物质混合施用 ②酸性土壤可用氢氧化钠固体改良 |
| C | ①洗洁精清除油污利用了乳化作用 ②硝酸铵溶于水使溶液的温度降低 | D | ①木柴架空有利于木柴 的完全燃烧 ②用细沙灭火降低了可燃物着火点 |
| A. | A | B. | B | C. | C | D. | D |
18.判断推理是学习化学常用的思维方式,下列判断正确的是( )
| A. | 碘酒能使淀粉变蓝,则可用加碘食盐检验面粉中是否含有淀粉 | |
| B. | 氧气有助燃性,则氧气可作燃料 | |
| C. | 取少量久置的氢氧化钠溶液,加入过量的氯化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞溶液,溶液由无色变红色,证明氢氧化钠溶液部分变质 | |
| D. | 中和反应的产物是盐和水,则生成盐和水的反应一定是中和反应 |

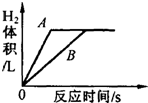 某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积
某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积