题目内容
13.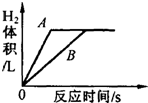 某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积
某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积(气体体积都在相同状况下测定)与反应时间的关系如图所示.根据此图,请你写出两条结论.
(1)反应速率:A>B;
(2)金属活动性:A>B.
分析 不同的足量的金属和等质量等质量分数的稀盐酸反应时,哪一种金属反应完全所需要的时间短,则说明哪一种金属的活动性强.
解答 解:根据图象不难看出,A反应完所需要的时间短,即A的金属活动性强,或A的反应速率快等;故答案为:反应速率:A>B,金属活动性:A>B(合理即可)
点评 本题难度不是很大,主要考查了对金属活动性顺序的应用,培养学生对知识的应用能力.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
4.化学与日常生活、工农业生产密切相关.下列说法中不正确的是( )
| A. | 用含有碳酸氢钠的发酵粉焙制糕点 | B. | 工业上用熟石灰处理硫酸厂的污水 | ||
| C. | 医疗上用氢氧化钠治疗胃酸过多 | D. | 生活中常用热的纯碱溶液去油污 |
1.下列是实验室制取CO2的部分操作,错误的是( )
| A. |  倾倒稀盐酸 | B. |  收集气体 | C. |  检查气密性 | D. |  验满 |
5.下列对某一主题的知识归纳,有错误的一组是( )
| A化学常识 | B化学与安全 |
| 铁生锈的条件:与水、氧气同时接触 检验化纤织物、纯毛织物:用灼烧闻气味来鉴别 | 稀释浓硫酸:小心地将水倒入浓硫酸并搅拌 厨房煤气泄漏:立即打开排油烟机排出毒气 |
| C化学与生活 | D化学与能源 |
| 硬水转化为软水:煮沸、蒸馏 硬水和软水鉴别:用肥皂水 | 沼气、酒精:生物能源,可再生能源 石油、煤:化石能源,不可再生能源 |
| A. | A | B. | B | C. | C | D. | D |
2.区分下列各组物质的两种方法都正确的是( )
| 选项 | A | B | C | D |
| 需区分的物质 | 软水和蒸馏水 | 氨气和二氧化碳 | 食盐水和纯碱溶液 | 聚乙烯和聚氯乙烯 |
| 方案一 | 加肥皂水搅拌 | 闻气味 | 滴加酚酞溶液 | 点燃闻气味 |
| 方案二 | 观察颜色 | 观察颜色 | 滴加食醋 | 加热,看是否熔化 |
| A. | A | B. | B | C. | C | D. | D |

 如图是某胃药标签的部分内容.小明同学测定该药品中NaHCO3含量的过程如下:去10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的PH=7时(已知药品中的其他成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g.称 得反应后烧杯内物质的总质量为64.3g.请计算:
如图是某胃药标签的部分内容.小明同学测定该药品中NaHCO3含量的过程如下:去10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的PH=7时(已知药品中的其他成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g.称 得反应后烧杯内物质的总质量为64.3g.请计算:


