题目内容
19.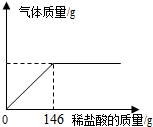 某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品24.0g,向其中加入10%的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,(1)小明要从反应后的溶液中提取NaCl应采用的方法是蒸发结晶;
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品24.0g,向其中加入10%的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,(1)小明要从反应后的溶液中提取NaCl应采用的方法是蒸发结晶;(2)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(3)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程).
分析 (1)从溶液中提取NaCl的方法是蒸发结晶;
(2)根据稀盐酸的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品的质量解答即可;
(3)根据稀盐酸的质量计算出生成的氯化钠的质量,再加上原来的氯化钠质量,除以反应后总溶液质量即可解答
解答 (1)从溶液中提取NaCl的方法是蒸发结晶;
故填:蒸发结晶;
(2)解:设24g纯碱样品中含Na2CO3的质量为x,生成NaCl 的质量为y,生成CO2 的质量为z,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 146gx10% y z
$\frac{106}{x}=\frac{73}{146g×10%}=\frac{117}{y}=\frac{44}{z}$
x=21.2g
y=23.4g
z=8.8g;
纯碱样品中的Na2CO3的质量分数是:$\frac{21.1g}{24g}×$100%=88.3%;
(3)反应后所得溶液中NaCl的质量分数是:$\frac{23.4g+(24g-21.2g)}{24g+146g-8.8g}$×100%=16.3%;
答:(2)纯碱样品中的Na2CO3的质量分数是88.3%;(3)反应后所得溶液中NaCl的质量分数是 16.3%.
点评 解答本题容易出错的地方是计算反应后所得溶液中NaCl 的质量分数时,容易忽略原来的氯化钠质量.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
9.以下是生活中常用的清洗剂,选择适当才可以得到更好的清洗效果.
(1)我们使用“洗涤灵”清洗餐具上的油污,这是因为它具有乳化的功能.
(2)“爆炸盐”溶于水后分解生成Na2CO3和H2O2.将“爆炸盐”溶于水后,所得溶液的pH>7.(填>、=或<).
(3)工业上将氯气(Cl2)通入烧碱溶液中可制取“消毒液”.反应后形成了NaCl和NaClO的溶液,NaClO的消毒原理是使细菌体内蛋白质发生化学变化.
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 爆炸盐 | 消毒液 |
| 产品 样式 |  |  |  |  |  |
| 有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 | 消毒 |
(2)“爆炸盐”溶于水后分解生成Na2CO3和H2O2.将“爆炸盐”溶于水后,所得溶液的pH>7.(填>、=或<).
(3)工业上将氯气(Cl2)通入烧碱溶液中可制取“消毒液”.反应后形成了NaCl和NaClO的溶液,NaClO的消毒原理是使细菌体内蛋白质发生化学变化.
10.下列实验方法中,一般不用于实验室制取氧气的是( )
| A. | 往二氧化锰中滴加双氧水 | B. | 电解水 | ||
| C. | 加热氯酸钾和二氧化锰的混合物 | D. | 加热高锰酸钾 |
7.下列有关本次模拟考试用纸的性质中,属于化学性质的是( )
| A. | 白色 | B. | 难溶于水 | C. | 易撕碎 | D. | 可燃性 |
4.善于梳理化学知识,能使你头脑更聪明.表中完全正确的一组是( )
| A.现象与解释 | B.资源与环境 |
| (1)热胀冷缩--分子的大小随温度变化而改变 (2)气体易被压缩--气态物质分子间的间隔较大 (3)十里桂花香--分子在不断地运动 | (1)工业废水可直接排放 (2)石油是工业的血液,应保护好南海及其石油资源 (3)稀土是不可再生的重要战略资源,应合理利用和保护 |
| C.燃烧与灭火 | D.化学与生活 |
| (1)燃烧是人类最早利用的化学反应之一 (2)温度达到可燃物的着火点就一定燃烧 (3)炒菜时油锅着火,可用锅盖盖灭 | (1)合理膳食,利于健康 (2)吸烟有害,尽早戒烟 (3)鉴别棉、毛,用火灼烧 |
| A. | 现象与解释 | B. | 资源与环境 | C. | 燃烧与灭火 | D. | 化学与生活 |
11.最近某些国家的科技人员研制出自动灭火砖.这种砖砌成的房屋发生火灾时,在高温烘烧下,砖会裂开喷出二氧化碳,从而扑灭火焰.自动灭火转的主要灭火原理是( )
| A. | 移走可燃物 | B. | 降低可燃物的着火点 | ||
| C. | 使可燃物与氧气隔绝 | D. | 使可燃物的温度降到着火点以下 |
8.反应前密闭容器分别含有甲、乙、丙、丁、戊5种物质各10克,充分反应后,测得各物质的质量如表,则下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 反应后的质量/克 | 26 | 10 | 0 | 待测 | 4 |
| A. | 参加反应的物质质量比为5:2 | B. | 乙是反应的催化剂 | ||
| C. | 反应后生成甲物质26g | D. | 该反应属于化合反应 |
 如图是用来表示某物质发生化学变化的微观示意图.图中○和●分别表示两种元素的原子,仔细观察下图,回答下列问题:
如图是用来表示某物质发生化学变化的微观示意图.图中○和●分别表示两种元素的原子,仔细观察下图,回答下列问题: