题目内容
9.现将Cu2O和Cu的固体混合物6.8g放入烧杯中,加入过量稀硫酸,充分反应后,过滤、洗涤、干燥,得到4.8g固体.已知:Cu2O+H2SO4═CuSO4+Cu+H2O,则原混合物中Cu2O与Cu的质量比是( )| A. | 9:8 | B. | 9:4 | C. | 17:12 | D. | 9:16 |
分析 铜不能稀硫酸反应,氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,可以假设氧化亚铜的质量,根据化学方程式可以计算反应生成铜的质量,生成的铜的质量和原混合物中铜的质量之和是4.8g.
解答 解:设原混合物中的Cu2O的质量为x,生成铜的质量为y,
Cu2O+H2SO4=CuSO4+Cu+H2O,
144 64
x y
$\frac{144}{64}$=$\frac{x}{y}$
y=$\frac{64x}{144}$,
根据题意有:6.8g-x+$\frac{64x}{144}$=4.8g,
x=3.6g,
原混合物中的Cu的质量为:6.8g-3.6g=3.2g,
则原混合物中的Cu2O和Cu质量比为:3.6g:3.2g=9:8,
故选:A.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
4.尿素[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如图所示:
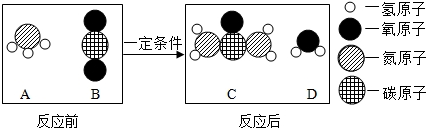
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 图中A、B、C、D四种物质都是氧化物 | |
| B. | 该反应属于复分解反应 | |
| C. | 该反应前后分子种类、原子种类均没有改变 | |
| D. | 反应中A、B物质的质量比为17:22 |
1.分类是化学学习和研究的重要方法之一,下列分类中正确的是( )
| A. | 冰水共存物、石灰水、空气都是混合物 | |
| B. | 小苏打、纯碱、高锰酸钾都是盐 | |
| C. | 硝酸钾、磷酸铵、硝酸铵都是复合肥 | |
| D. | 塑料、合成橡胶、铜锌合金都是合成材料 |
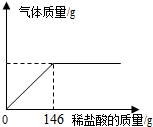 某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品24.0g,向其中加入10%的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,(1)小明要从反应后的溶液中提取NaCl应采用的方法是蒸发结晶;
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品24.0g,向其中加入10%的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,(1)小明要从反应后的溶液中提取NaCl应采用的方法是蒸发结晶;