题目内容
8. 如图是一个太阳能黑光灯灭虫装置,上方的薄膜太阳能电池组将太阳能转化成电能,为诱虫的黑光灯及高压金属触杀网供电.
如图是一个太阳能黑光灯灭虫装置,上方的薄膜太阳能电池组将太阳能转化成电能,为诱虫的黑光灯及高压金属触杀网供电.(1)长期使用农药会使害虫产生抗药性,这是自然选择的结果,而用黑光灯诱杀害虫,对虫害的防治更具有可持续性,并减少对环境的污染.
(2)含镉(Cd)化合物是生产薄膜太阳能电池的重要原料,所以生产过程中会产生大量含镉的固体废弃物,长期露天堆放会造成土壤污染.
溶解在土壤中的镉会被植物吸收,并通过食物链进入人体,对人体造成多种危害.
(3)为保护环境,对含镉固体废弃物必须及时处理.下面是处理过程中某一重要反应:CdSO4+Na2S═CdS↓+Na2SO4,通过该反应以减轻对土壤的污染的基本原理是把可溶性的CdSO4转化为不溶性的CdS.
分析 (1)此题考查的知识点是害虫抗药性的形成.解答时可以从自然选择和抗药性形成的过程方面来切入.
(2)土壤污染是指土壤中积累有毒、有害物质,引起对植物生长的危害,或者残留在农作物中进入食物链而危害人体健康.
(3)根据化学反应的方程式进行分析.
解答 解:(1)达尔文把在生存斗争中,适者生存、不适者被淘汰的过程叫做自然选择.遗传变异是生物进化的基础,首先害虫的抗药性存在着变异.有的抗药性强,有的抗药性弱.使用农药时,把抗药性弱的害虫杀死,这叫不适者被淘汰;抗药性强的害虫活下来,这叫适者生存.活下来的抗药性强的害虫,繁殖的后代有的抗药性强,有的抗药性弱,在使用农药时,又把抗药性弱的害虫杀死,抗药性强的害虫活下来.这样经过若干代的反复选择.最终活下来的害虫大多是抗药性强的害虫.在使用同等剂量的农药时,就不能起到很好的杀虫作用,导致害虫产生抗药性.
(2)溶解在土壤中的镉会被植物吸收,说明有毒物质会随着食物链的传递积累,最终危害人的健康.
(3)由化学方程式CdSO4+Na2S═CdS↓+NaSO4可知,通过该反应把可溶性的CdSO4转化为不溶性的CdS.
故答案为:(1)自然选择;
(2)食物链;
(3)把可溶性的CdSO4转化为不溶性的CdS.
点评 本题综合能力较强,考查的知识点很多,有一定难度,这要求学生多读多了解物理知识在生活中的应用情况.

练习册系列答案
相关题目
18.下列图象中有关量的变化趋势与对应叙述关系成立的是( )
| A. |  加热木炭粉与氧化铜的混合物 | B. |  锌粒加入一定量的稀盐酸中 | ||
| C. |  点燃的硫伸入装满氧气的集气瓶中 | D. |  一定量稀硫酸中滴加氢氧化钡溶液 |
16.熟石灰在部分温度下的溶解度如下表所示.
(1)20℃时,0.56g氧化钙放入到盛有100g水的烧杯中.恢复到20℃时,所得溶液中水的质量减小(填“增大”“减小”或“不变”),溶液中溶质的质量分数是$\frac{0.16g}{0.16g+100g}$×100%(写计算式).
(2)采用一种操作方法,将上述烧杯中剩余固体全部溶解,变为不饱和溶液.下列说法正确的是B.
A.溶液的质量可能不变
B.溶液中溶质的质量分数一定减小
C.溶液中溶质的质量一定增大
D.可以升温使之变成不饱和溶液.
| 温度/℃ | O | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | O.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 |
(2)采用一种操作方法,将上述烧杯中剩余固体全部溶解,变为不饱和溶液.下列说法正确的是B.
A.溶液的质量可能不变
B.溶液中溶质的质量分数一定减小
C.溶液中溶质的质量一定增大
D.可以升温使之变成不饱和溶液.
3.化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
【查得资料】(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生.
(2)饱和碳酸氢钠溶液不吸收二氧化碳.
【设计实验】小组同学设计了如图所示装置(图中夹持仪器略去) 测定牙膏样品中碳酸钙的含量.
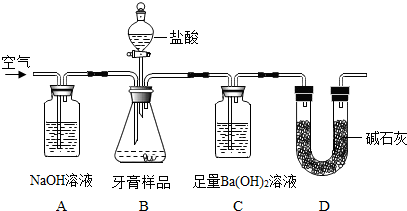
依据图示回答下列问题:
(1)该装置中氢氧化钠溶液的作用是吸收空气中的二氧化碳.
(2)C中观察到有沉淀产生,反应的化学方程式为CO2+Ba(OH)2=BaCO3↓+H2O.
(3)实验过程中需持续缓缓通入空气,其作用有使反应产生的二氧化碳全部被氢氧化钡溶液吸收.
【解释与结论】实验测得如下数据:
欲计算样品中碳酸钙的含量,应选择的数据是三组数据的平均值.
【反思与评价】
(1)有人认为不必测定C中沉淀的质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是氢氧化钡溶液吸收了挥发出的氯化氢气体.
(2)反思实验过程,小刚同学提出应采取必要措施,提高测定准确度.他提出的下列各项措施中,不能提高测定准确度的是bcd(填字母序号).
a.在加入盐酸之前,排净装置内的CO2气体
b.放慢滴加盐酸的速度
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置.
【查得资料】(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生.
(2)饱和碳酸氢钠溶液不吸收二氧化碳.
【设计实验】小组同学设计了如图所示装置(图中夹持仪器略去) 测定牙膏样品中碳酸钙的含量.

依据图示回答下列问题:
(1)该装置中氢氧化钠溶液的作用是吸收空气中的二氧化碳.
(2)C中观察到有沉淀产生,反应的化学方程式为CO2+Ba(OH)2=BaCO3↓+H2O.
(3)实验过程中需持续缓缓通入空气,其作用有使反应产生的二氧化碳全部被氢氧化钡溶液吸收.
【解释与结论】实验测得如下数据:
| 实验次数 | 样品质量(g) | 所用盐酸质量(g) | 所得沉淀质量(g) |
| 第一次 | 8.00 | 50 | 1.95 |
| 第二次 | 8.00 | 50 | 1.98 |
| 第三次 | 8.00 | 50 | 1.96 |
【反思与评价】
(1)有人认为不必测定C中沉淀的质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是氢氧化钡溶液吸收了挥发出的氯化氢气体.
(2)反思实验过程,小刚同学提出应采取必要措施,提高测定准确度.他提出的下列各项措施中,不能提高测定准确度的是bcd(填字母序号).
a.在加入盐酸之前,排净装置内的CO2气体
b.放慢滴加盐酸的速度
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置.
13.酸雨是全球三大环境问题之一,下列各项与形成酸雨无关的是( )
| A. | 硫酸厂的废气直接排放 | B. | 汽车尾气直接排放 | ||
| C. | 含硫煤的燃烧 | D. | 建筑工地的尘土飞扬 |
17.将一定量的酒精(学名乙醇)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸汽和一种未知物X.测得反应前后物质的质量如下表:
下列判断错误的是( )
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
| A. | 表中m的值为2.8 | |
| B. | X中氧元素的质量为1.6g | |
| C. | 增加氧气的量可以减少X的生成 | |
| D. | 物质X一定含有1.2g碳元素,可能含有氢元素 |
18.在小组活动中,老师讲烘干的碳酸镁与锌粉按照一定比例研细混匀,按照图1进行实验.
【提出问题】碳酸镁与锌粉反应的产物是什么?
【查阅资料】①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液.
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体.
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
结论:碳酸镁与锌粉反应的气体燃烧的化学方程式为2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.

2)实验二:碳酸镁与锌粉反应的固体产物是什么?
老师将加热后的剩余固体分成两份,由甲、乙两组同学进行探究.
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰.C处点燃的气体是H2(填化学式).甲组同学获得结论:该反应的固体产物是碳酸锌和镁.
乙组同学提出了质疑,他们先将另一份剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化.他们对剩余固体的处理操作是继续按图1方式加热,直至不再产生气体.乙组同学利用实验现象,分析碳酸镁与锌粉反应的化学方程式为MgCO3+Zn$\frac{\underline{\;\;△\;\;}}{\;}$MgO+ZnO+CO↑.甲组同学对实验过程再次进行了认真分析,确定他们放入试管A中的固体含有MgCO3、Zn、MgO、ZnO.
【实验反思】:通过以上实验说明,在研究反应后的产物时.要考虑反应物是否有剩余.
【提出问题】碳酸镁与锌粉反应的产物是什么?
【查阅资料】①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液.
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体.
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
| 序号 | 实验操作 | 实验现象 |
| ① | 收集两瓶气体,盖好玻璃片,停止加热,向其中一瓶迅速倒入少量澄清石灰水,盖好振荡. | 无明显现象. |
| ② | 将另一瓶气体点燃,待火焰熄灭后,迅速倒入少量澄清石灰水,盖好振荡. | 气体安静燃烧,火焰呈蓝色,澄清石灰水变浑浊. |

2)实验二:碳酸镁与锌粉反应的固体产物是什么?
老师将加热后的剩余固体分成两份,由甲、乙两组同学进行探究.
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰.C处点燃的气体是H2(填化学式).甲组同学获得结论:该反应的固体产物是碳酸锌和镁.
乙组同学提出了质疑,他们先将另一份剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化.他们对剩余固体的处理操作是继续按图1方式加热,直至不再产生气体.乙组同学利用实验现象,分析碳酸镁与锌粉反应的化学方程式为MgCO3+Zn$\frac{\underline{\;\;△\;\;}}{\;}$MgO+ZnO+CO↑.甲组同学对实验过程再次进行了认真分析,确定他们放入试管A中的固体含有MgCO3、Zn、MgO、ZnO.
【实验反思】:通过以上实验说明,在研究反应后的产物时.要考虑反应物是否有剩余.
 如图是水分子分解示意图,下列说法正确的是( )
如图是水分子分解示意图,下列说法正确的是( )