题目内容
1.大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,如图是工业对海水进行几项综合利用的示意图,根据图示填空: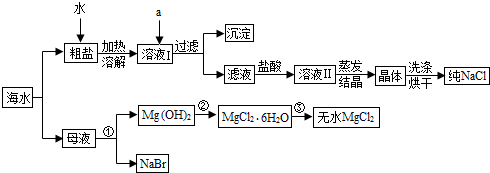
(1)某课外化学活动小组取海水,蒸发、结晶,然后过滤,得到粗盐,过滤时,必须用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)粗盐中除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂志,如果井水或溪水中含有的Ca2+、Mg2+较多,这种水称作硬水(填硬水、软水),日常生活中降低水中Ca2+、Mg2+的方法是加热煮沸.欲除去溶液Ⅰ中的MgCl2、CaCl2、Na2SO4,从Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、过量的BaCl2溶液、过量碳酸钠溶液.加入BaCl2溶液发生反应的化学方程式为BaCl2+Na2SO4=BaSO4↓+2NaCl;BaCl2溶液不能用Ba(NO3)2溶液代替的原因避免带入新的杂质离子.
(3)在滤液中加盐酸的作用是除去NaOH和Na2CO3,反应的化学方程式为NaOH+HCl=NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑.
分析 (1)过滤时用的仪器有:烧杯、玻璃棒、漏斗、铁架台;
(2)根据硬水的概念和降低硬度的方法来解答;欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化镁除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
(3)在滤液中加盐酸的作用,应考虑除去NaOH、Na2CO3溶液.
解答 解:(1)过滤时用的仪器有:烧杯、玻璃棒、漏斗、铁架台,其中的玻璃仪器是:漏斗、烧杯、玻璃棒.故答案为:玻璃棒;
(2)含有的Ca2+、Mg2+较多,这种水称作硬水,日常生活中降低水中Ca2+、Mg2+的方法是加热煮沸;欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡,正确滴加顺序依次为:过量的NaOH溶液、过量氯化钡溶液、过量碳酸钠溶液;氯化钡与硫酸钠反应生成硫酸钡白色沉淀和氯化钠;BaCl2溶液不能用Ba(NO3)2溶液代替的原因防止代入新的杂质离子--硝酸根离子;故答案为:硬水;加热煮沸;过量的NaOH溶液;过量碳酸钠溶液;BaCl2+Na2SO4=BaSO4↓+2NaCl;避免带入新的杂质离子;
(3)在滤液中加盐酸可以跟氢氧化钠和过量的碳酸钠反应,除去NaOH、Na2CO3溶液.故答案为:除去NaOH和Na2CO3;NaOH+HCl=NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 本题考查了物质的除杂难度比较大,特别的除去食盐中的多种杂质,要根据除杂的原理深入思考,按照最优化的顺序添加除杂剂.

练习册系列答案
相关题目
2.下列图示的实验操作正确的是( )
| A. |  检验气密性 | B. |  稀释浓硫酸 | C. |  量取液体体积 | D. |  加热液体 |
20.下列生活中的物质,属于纯净物的是( )
| A. | 小苏打 | B. | 加碘盐 | C. | 酱油 | D. | 白酒 |
7.下列各组离子能在指定溶液中大量共存的一组是( )
| A. | 在稀盐酸中:Ag+、NO3- | B. | 在硫酸钠溶液中:Ba2+、Cl- | ||
| C. | 在硝酸钠溶液中:Zn2+、SO42- | D. | 在碳酸氢铵溶液中:K+、OH- |
6.善于归纳知识,利于培养素质.小林同学整理的下列内容有错误的是( )
| A.除杂的方法 | B.物质与俗名 |
| ①粗盐难溶性杂质去除--溶解、过滤、蒸发、干燥 ②木炭粉中混有铁粉--用磁铁吸引 ③CaO中混有石灰石--高温煅烧 | ①乙醇--酒精 ②碳酸钠--纯碱、苏打 ③氢氧化钠--火碱、烧碱、苛性钠 |
| C.安全常识 | D.化学与生活 |
| ①厨房煤气管漏气--关闭阀门并开窗通风 ②实验时碰倒酒精灯着火--用湿抹布盖灭 ③冬天用煤炉取暖--保证室内通风 | ①人体缺铁会引起贫血症 ②多吃水果蔬菜利于补充维生素 ③使用可降解塑料可减少“白色污染” |
| A. | A | B. | B | C. | C | D. | D |
13.下列鉴别物质所用的方法或试剂,错误的是( )
| A. | 蒸馏水与氯化钙溶液--肥皂水 | B. | 铁粉和炭粉--观察颜色 | ||
| C. | 羊毛和化学纤维--点燃闻气味 | D. | 氢氧化钠溶液和水--用酚酞溶液 |

