题目内容
硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4?y(NH4)2SO4?zH2O,在制药、电镀方面有广泛的应用.
资料:①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去.
【探究一】:制备硫酸亚铁铵晶体
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如图1:
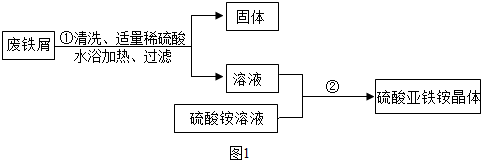
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌.以除去废铁屑表面的油污,这是利用洗涤剂的 作用;
(2)操作①中发生反应的化学方程式为 ;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、 .过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是 ;
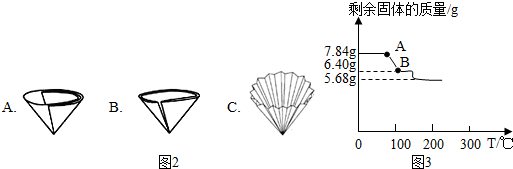
(4)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 ;
(5)操作②的目的是得到硫酸亚铁铵晶体.操作顺序是b→ → →d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干.这样做的优点是 ;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验.向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀.
回答下列问题:
(7)实验中生成的NH3能使湿润的 变蓝;写出(NH4)2SO4与NaOH反应的化学方程式 ,属于 反应;
(8)实验中加入过量BaCl2溶液的目的 ;
(9)取最后一次洗涤液,加入Na2SO4溶液, ,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图3所示.则:
(11)根据图示数据,硫酸亚铁铵晶体中,x:y:z= ;
(12)写出A点到B点发生反应的化学方程式 .
资料:①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ | FeSO4 | (NH4)2SO4 | xFeSO4?y(NH4)2SO4?zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78 | 28.1 |
【探究一】:制备硫酸亚铁铵晶体
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如图1:

(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌.以除去废铁屑表面的油污,这是利用洗涤剂的
(2)操作①中发生反应的化学方程式为
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、

(4)操作①中过滤时,要趁热进行的原因是
(5)操作②的目的是得到硫酸亚铁铵晶体.操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干.这样做的优点是
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验.向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀.
回答下列问题:
(7)实验中生成的NH3能使湿润的
(8)实验中加入过量BaCl2溶液的目的
(9)取最后一次洗涤液,加入Na2SO4溶液,
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图3所示.则:
(11)根据图示数据,硫酸亚铁铵晶体中,x:y:z=
(12)写出A点到B点发生反应的化学方程式
考点:物质的相互转化和制备,实验探究物质的组成成分以及含量,过滤的原理、方法及其应用,常见气体的检验与除杂方法,金属的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备,科学探究
分析:(1)根据乳化作用的概念解答;
(2)根据铁和稀硫酸反应生成硫酸亚铁和氢气书写;
(3)根据过滤要用到的玻璃仪器包括:烧杯、漏斗、玻璃棒解答;
(4)铜不会和硫酸反应,所以可以过滤出来;根据硫酸亚铁的溶解性表格可知;
(5)根据制取硫酸亚铁晶体的基本操作解答;
(6)硫酸亚铁难溶于酒精可知.
(7)根据氨气能和水反应生成氨水,氨水呈碱性能使石蕊变蓝色;(NH4)2SO4与NaOH反应生成硫酸钠、水和氨气和复分解反应的定义解答;
(8)根据硫酸铵和氯化钡反应生成硫酸钡沉淀和氯化铵分析解答;
(9)证明氯化钡过量只要证明钡离子有剩余即可;
(10)根据硫酸铵和氯化钡反应的化学方程式计算出硫酸铵的质量;再硫酸铵和氯化钡反应生成硫酸钡沉淀的质量,然后用9.32g减去求出来的硫酸钡的质量既是硫酸钠和氯化钡反应产生沉淀的质量解答;
(11)图象中的A到B就是xFeSO4?y(NH4)2SO4?zH2O分解得到水蒸气的质量;
(12)A到B时xFeSO4?y(NH4)2SO4?zH2O分解得到的硫酸铵、硫酸亚铁铵晶体和水的过程.
(2)根据铁和稀硫酸反应生成硫酸亚铁和氢气书写;
(3)根据过滤要用到的玻璃仪器包括:烧杯、漏斗、玻璃棒解答;
(4)铜不会和硫酸反应,所以可以过滤出来;根据硫酸亚铁的溶解性表格可知;
(5)根据制取硫酸亚铁晶体的基本操作解答;
(6)硫酸亚铁难溶于酒精可知.
(7)根据氨气能和水反应生成氨水,氨水呈碱性能使石蕊变蓝色;(NH4)2SO4与NaOH反应生成硫酸钠、水和氨气和复分解反应的定义解答;
(8)根据硫酸铵和氯化钡反应生成硫酸钡沉淀和氯化铵分析解答;
(9)证明氯化钡过量只要证明钡离子有剩余即可;
(10)根据硫酸铵和氯化钡反应的化学方程式计算出硫酸铵的质量;再硫酸铵和氯化钡反应生成硫酸钡沉淀的质量,然后用9.32g减去求出来的硫酸钡的质量既是硫酸钠和氯化钡反应产生沉淀的质量解答;
(11)图象中的A到B就是xFeSO4?y(NH4)2SO4?zH2O分解得到水蒸气的质量;
(12)A到B时xFeSO4?y(NH4)2SO4?zH2O分解得到的硫酸铵、硫酸亚铁铵晶体和水的过程.
解答:解:(1)倒入热水和洗涤剂,充分搅拌,以除去废铁屑表面的油污,这是利用洗涤剂的乳化作用;故答案:乳化;
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;故答案:Fe+H2SO4=FeSO4+H2↑;
(3)过滤要用到的玻璃仪器包括:烧杯、漏斗、玻璃棒,故答案:漏斗;A;
(4)加入稀硫酸后,铁可以和硫酸反应生成硫酸亚铁和氢气,但铜不会和硫酸反应,因此铜就被过滤出来;根据硫酸亚铁的溶解表格可知,硫酸亚铁在50℃到80℃时溶解度是比较大的;故答案为:增大硫酸亚铁的溶解度;Cu.
(5)操作②的目的是得到硫酸亚铁铵晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥.
(6)硫酸亚铁溶于水不溶于酒精,用A方法洗涤硫酸亚铁晶体损失较多,可用酒精洗涤,酒精又易挥发,能得到大量的纯净的硫酸亚铁晶体,故答案:AB;
(7)氨气能和水反应生成氨水,氨水呈碱性能使石蕊变蓝色;(NH4)2SO4与NaOH反应生成硫酸钠、水和氨气;该反应生成两种化合物相互交换成分生成另外两种化合物的反应,属复分解反应; 答案:紫色石蕊试纸;(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O;复分解反应;
(8)氯化钡和硫酸亚铁反应生成硫酸钡沉淀和氯化铁,氯化钡过量就是为了将硫酸根离子全部沉淀,故答案:将硫酸根离子全部沉淀;
(9)加入硫酸钠若不产生白色沉淀证明沉淀上已不附着BaCl2,则说明沉淀已经洗涤干净,故答案:若不产生白色沉淀;
(10)设硫酸亚铁铵晶体中硫酸铵的质量为x;
(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O
132 34
y 0.68g
=
y=2.64g
设和硫酸铵反应生成硫酸钡沉淀的质量为y
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
132 233
2.64g y
=
y=4.66g
所以和硫酸亚铁反应产生硫酸钡沉淀的质量为9.32g-4.66g=4.66g;
设和硫酸亚铁反应生成硫酸钡沉淀的质量为z
FeSO4+BaCl2=BaSO4↓+FeCl2
152 233
z 4.66g
=
z=3.04g
硫酸亚铁铵中
=
;
=
;故答案:1:1;
(11)由A→B固体质量减轻的质量就是生成的水的质量,7.84g硫酸亚铁铵晶体中水的质量为7.84g-5.68g=2.16g,
=
;
=
故答案:1:1:6;
(12)加热FeSO4?(NH4)2SO4?6H2O分解得到硫酸亚铁、硫酸铵、和水;故答案:FeSO4?(NH4)2SO4?6H2O
FeSO4+(NH4)2SO4?2H2O+4H2O.
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;故答案:Fe+H2SO4=FeSO4+H2↑;
(3)过滤要用到的玻璃仪器包括:烧杯、漏斗、玻璃棒,故答案:漏斗;A;
(4)加入稀硫酸后,铁可以和硫酸反应生成硫酸亚铁和氢气,但铜不会和硫酸反应,因此铜就被过滤出来;根据硫酸亚铁的溶解表格可知,硫酸亚铁在50℃到80℃时溶解度是比较大的;故答案为:增大硫酸亚铁的溶解度;Cu.
(5)操作②的目的是得到硫酸亚铁铵晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥.
(6)硫酸亚铁溶于水不溶于酒精,用A方法洗涤硫酸亚铁晶体损失较多,可用酒精洗涤,酒精又易挥发,能得到大量的纯净的硫酸亚铁晶体,故答案:AB;
(7)氨气能和水反应生成氨水,氨水呈碱性能使石蕊变蓝色;(NH4)2SO4与NaOH反应生成硫酸钠、水和氨气;该反应生成两种化合物相互交换成分生成另外两种化合物的反应,属复分解反应; 答案:紫色石蕊试纸;(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O;复分解反应;
(8)氯化钡和硫酸亚铁反应生成硫酸钡沉淀和氯化铁,氯化钡过量就是为了将硫酸根离子全部沉淀,故答案:将硫酸根离子全部沉淀;
(9)加入硫酸钠若不产生白色沉淀证明沉淀上已不附着BaCl2,则说明沉淀已经洗涤干净,故答案:若不产生白色沉淀;
(10)设硫酸亚铁铵晶体中硫酸铵的质量为x;
(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O
132 34
y 0.68g
| 132 |
| 34 |
| y |
| 0.68g |
y=2.64g
设和硫酸铵反应生成硫酸钡沉淀的质量为y
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
132 233
2.64g y
| 132 |
| 233 |
| 2.64g |
| y |
y=4.66g
所以和硫酸亚铁反应产生硫酸钡沉淀的质量为9.32g-4.66g=4.66g;
设和硫酸亚铁反应生成硫酸钡沉淀的质量为z
FeSO4+BaCl2=BaSO4↓+FeCl2
152 233
z 4.66g
| 152 |
| 233 |
| z |
| 4.66g |
z=3.04g
硫酸亚铁铵中
| 3.04g |
| 2.64g |
| 152x |
| 132y |
| x |
| y |
| 1 |
| 1 |
(11)由A→B固体质量减轻的质量就是生成的水的质量,7.84g硫酸亚铁铵晶体中水的质量为7.84g-5.68g=2.16g,
| 132y |
| 18z |
| 2.64g |
| 2.16g |
| y |
| z |
| 1 |
| 6 |
(12)加热FeSO4?(NH4)2SO4?6H2O分解得到硫酸亚铁、硫酸铵、和水;故答案:FeSO4?(NH4)2SO4?6H2O
| ||
点评:通过这个题培养学生观察视图的能力,以及比较分析的能力.本题考查了常见金属的性质以及某些盐的性质,完成此题,可以依据题干提供的内容,从中抽取有用的信息,结合已有的知识进行.本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见金属的性质以及某些盐的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目

 硝酸钾是初中化学常见的一种物质.请按要求填空:
硝酸钾是初中化学常见的一种物质.请按要求填空:
 如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合如图要求的是( )
如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合如图要求的是( )