题目内容
12.为测定某纯碱样品中碳酸钠的质量分数,现称取样品21g,加入到盛有60g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为74.4g,则该纯碱样品中碳酸钠的质量是多少?分析 根据质量守恒定律计算生成二氧化碳的质量,依据化学方程式计算参加反应的碳酸钠的质量.
解答 解:生成二氧化碳的质量为:21g+60g-74.4g=6.6g,
设该纯碱样品中碳酸钠的质量是x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
x 6.6g
$\frac{106}{x}$=$\frac{44}{6.6g}$
x=15.9g
故答案为:该纯碱样品中碳酸钠的质量是15.9g.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
20.用下图所示实验装置进行相应实验,不能达到实验目的是( )
| A. |  收集氢气 | |
| B. |  验证二氧化碳的密度大于空气 | |
| C. |  配制20%的溶液 | |
| D. |  向左推动针筒活塞可检验该装置的气密性 |
1.科学实验中、准确地分析实验数据是得到科学结论的保证.下列4个图象,能正确反映对应关系的是( )
| A. |  常温下,稀释KOH溶液 | |
| B. |  甲烷和过量的氧气在密闭容器中完全反应 | |
| C. | 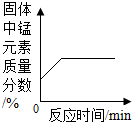 加热一定质量高锰酸钾固体 | |
| D. |  在装有稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量 |
2.下列实验操作中,正确的是( )
| A. |  检验CO2是否集满 | B. |  加热液体 | ||
| C. |  滴加液体 | D. |  称量NaOH固体质量 |


 水是生命之源,我们应该了解水、爱护水.
水是生命之源,我们应该了解水、爱护水. 2015年12月,某餐厅发生一起爆炸事故,现场伴有大量浓烟冒出,距离事故发生地一千米左右,还能闻到浓浓的刺鼻味.消防部门第一时间赶到现场,扑灭大火,减少了人员伤亡和财产损失.根据要求回答问题:
2015年12月,某餐厅发生一起爆炸事故,现场伴有大量浓烟冒出,距离事故发生地一千米左右,还能闻到浓浓的刺鼻味.消防部门第一时间赶到现场,扑灭大火,减少了人员伤亡和财产损失.根据要求回答问题: