题目内容
1. 向100g稀H2S04溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的Na0H溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示.请回答:
向100g稀H2S04溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的Na0H溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示.请回答:(1)0A段无沉淀产生,请写出反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
(2)加入镁粉的质量为2.4g.
(3)求稀硫酸中硫酸的质量分数.(写出计算过程,计算结果保留到0.1%)
分析 (1)根据开始没有沉淀生成,说明硫酸过量,所以OA段是硫酸和NaOH溶液反应生成硫酸钠和水,进行分析解答;
(2)根据生成沉淀氢氧化镁中镁元素的质量即为加入镁粉的质量进行解答;
(3)硫酸和金属镁反应生成硫酸镁和氢气,硫酸和NaOH溶液反应生成硫酸钠和水,硫酸镁和氢氧化钠溶液反应生成氢氧化镁沉淀和硫酸钠,反应的化学方程式分别为Mg+H2SO4═MgSO4+H2↑、H2SO4+2NaOH=Na2SO4+2H2O、MgSO4+2NaOH═Mg(OH)2↓+Na2SO4,最后硫酸全部生成硫酸钠,由反应前后硫酸根的质量不变,进而计算出稀硫酸中硫酸的质量分数.
解答 解:(1)开始没有沉淀生成,说明硫酸过量,所以OA段是硫酸和NaOH溶液反应生成硫酸钠和水,反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O;
(2)生成沉淀氢氧化镁中镁元素的质量即为加入镁粉的质量,由图可知生成氢氧化镁的质量为5.8g,所以加入镁粉的质量=5.8g×$\frac{24}{24+(16+1)×2}$×100%=2.4g;
(3)硫酸和金属镁反应生成硫酸镁和氢气,硫酸和NaOH溶液反应生成硫酸钠和水,硫酸镁和氢氧化钠溶液反应生成氢氧化镁沉淀和硫酸钠,反应的化学方程式分别为Mg+H2SO4═MgSO4+H2↑、H2SO4+2NaOH=Na2SO4+2H2O、MgSO4+2NaOH═Mg(OH)2↓+Na2SO4,最后硫酸全部生成硫酸钠;
设稀硫酸中溶质质量为x,
Na2SO4~2NaOH~H2SO4
80 98
80g×20% x
$\frac{98}{80}=\frac{x}{80g×20%}$ x=19.6g
稀硫酸中硫酸的质量分数为$\frac{19.6g}{100g}$×100%=19.6%.
答:(1)H2SO4+2NaOH=Na2SO4+2H2O;(2)2.4;(3)稀硫酸中硫酸的质量分数为19.6%.
点评 本题难度不大,掌握根据化学方程式与溶质质量分数的综合计算即可正确解答本题,细致地分析图表信息,确定氢氧化镁沉淀的质量是正确解答本题的前提和关键.

| A. | 长期放置在空气中的NaOH溶液的质量增加 | |
| B. | 久置在潮湿的空气中的铁钉的质量增加 | |
| C. | 久置在空气中的生石灰质量增加 | |
| D. | 长期敞口放置的浓H2SO4的质量增加 |
| A. |  测溶液的pH | B. |  稀释浓硫酸 | C. |  加热液体 | D. |  取用液体试剂 |
| A. | 铁和硫酸铜溶液 | B. | 氧化铁固体和稀硫酸 | ||
| C. | 盐酸和澄清石灰水 | D. | 氯化钠溶液和硝酸钾溶液 |
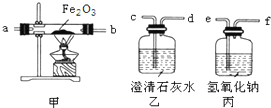 4月17日,重庆市渝中区石板坡的一幢民房发生火灾后,某中学化学兴趣小组想探究火灾现场附近的空气中是否含有CO气体.设计实验方案如下:
4月17日,重庆市渝中区石板坡的一幢民房发生火灾后,某中学化学兴趣小组想探究火灾现场附近的空气中是否含有CO气体.设计实验方案如下: 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.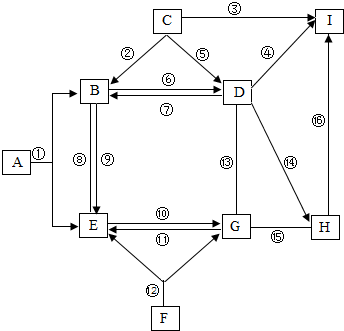 A~J都是初中化学中的常见物质,它们之间的关系如图所示(图中省略了反应条件,部分反应物或部分生成物),图中”→“表示箭尾的物质可转化成箭头的物质;”-“表示两端的物质能发生化学反应,”
A~J都是初中化学中的常见物质,它们之间的关系如图所示(图中省略了反应条件,部分反应物或部分生成物),图中”→“表示箭尾的物质可转化成箭头的物质;”-“表示两端的物质能发生化学反应,” “表示两端的物质能发生化学反应,又表示箭尾的物质可转化成箭头的物质;”?“表示两端物质间可互相转化,A是天然气的主要成分,I、H是两种常见的金属(其中金属I的颜色为红色).③和⑦的反应物质均为置换反应(形如AB+C→CB+A).请回答下列内容
“表示两端的物质能发生化学反应,又表示箭尾的物质可转化成箭头的物质;”?“表示两端物质间可互相转化,A是天然气的主要成分,I、H是两种常见的金属(其中金属I的颜色为红色).③和⑦的反应物质均为置换反应(形如AB+C→CB+A).请回答下列内容