题目内容
8.甲、乙、丙三位同学对食盐样品(仅含少量氯化镁杂质)进行如下检测:各取5.0g样品溶于足量的水中得到澄清溶液,再分别加入溶质质量分数相同的不同质量的氢氧化钠溶液,反应得到沉淀的实验数据如表:| 甲 | 乙 | 丙 | |
| 加入氢氧化钠溶液质量 (g) | 35.0 | 40.0 | 45.0 |
| 反应得到沉淀的质量 (g) | 2.5 | 2.9 | 2.9 |
(1)上述实验中,丙同学所用的氢氧化钠溶液一定过量.
(2)求样品中氯化镁的质量分数(写出计算过程,结果精确到0.1%).
分析 (1)根据图示数据和完全反应的概念进行分析;
(2)杂质氯化钠不能与氢氧化钠反应,利用氯化镁与氢氧化钠反应的化学方程式和生成沉淀的质量,列出比例式,即可计算出生成2.9克Mg(OH)2消耗MgCl2的质量和生成NaCl的质量;然后根据“混合物中MgCl2的质量分数=$\frac{混合物样品中氯化镁的质量}{混合物样品的质量}$×100%”计算即可;
解答 解:(1)由图示数据可知,乙同学用40.0g氢氧化钠溶液反应,得到2.9g沉淀,丙同学用45.0g氢氧化钠溶液反应,也得到2.9g沉淀.说明丙同学所用的氢氧化钠溶液一定过量.故答案为:丙;
(2)设生成2.9克Mg(OH)2消耗MgCl2的质量为x,
MgCl2+2NaOH═Mg(OH)2↓+2NaCI
95 58
x 2.9g
$\frac{95}{x}=\frac{58}{2.9g}$
x=4.75g;
混合物中MgCl2的质量分数为:$\frac{4.75g}{5.0g}$×100%=95.0%;
答:混合物中MgCl2的质量分数为95.0%.
点评 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
16.漂白粉可用于自来水的消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2].次氯酸钙中氯元素的化合价为( )
| A. | -1 | B. | +1 | C. | +2 | D. | +5 |
3.分析推理是化学学习中常用的思维方法.下列说法正确的是( )
| A. | 单质是由同种元素组成的,所以同种元素组成的物质都是单质 | |
| B. | 溶液具有均一、稳定的特征,所以均一、稳定的液体一定是溶液 | |
| C. | 化学变化都遵循质量守恒定律,所以质量不发生改变的变化就是化学变化 | |
| D. | 酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液呈酸性 |
13.在化学反应3H2+WO3$\frac{\underline{\;高温\;}}{\;}$W+3H2O中,氧化剂是( )
| A. | H2 | B. | W | C. | WO3 | D. | H2O |
20.如表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题.
(1)从表中数据可以获得的信息是同温下氢氧化钠的溶解度远远大于氢氧化钙的溶解度(写一条).
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是溶液变浑浊;现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙<甲(填“>”、“<”或“=”)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程.请回答:
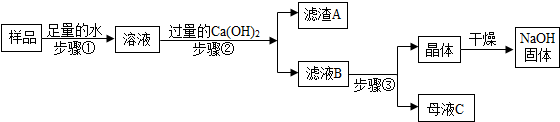
(Ⅰ)步骤②反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是使碳酸钠完全反应.
(Ⅱ)步骤③所包含的具体操作是加热浓缩、降温结晶.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是溶液变浑浊;现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙<甲(填“>”、“<”或“=”)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程.请回答:

(Ⅰ)步骤②反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是使碳酸钠完全反应.
(Ⅱ)步骤③所包含的具体操作是加热浓缩、降温结晶.
17.下列关于物质的认识正确的是( )
| A. | 所有溶液都能导电 | |
| B. | 不锈钢是永不生锈的钢铁 | |
| C. | 可燃性气体与空气充分接触一定发生爆炸 | |
| D. | 空气中CO2浓度过高,会对人体产生有害影响 |
18. 向盛有饱和澄清石灰水的烧杯中持续通入CO2出现了异常现象(先变浑浊后又变澄清.提示:过量的CO2会与CaCO3等反应生成可溶于水的Ca(HCO3)2),兴趣小组同学利用数字分析仪进行研究,测定记录得到溶液的导电性变化随二氧化碳的质量关系如下图所示.下列说法不正确的是( )
向盛有饱和澄清石灰水的烧杯中持续通入CO2出现了异常现象(先变浑浊后又变澄清.提示:过量的CO2会与CaCO3等反应生成可溶于水的Ca(HCO3)2),兴趣小组同学利用数字分析仪进行研究,测定记录得到溶液的导电性变化随二氧化碳的质量关系如下图所示.下列说法不正确的是( )
 向盛有饱和澄清石灰水的烧杯中持续通入CO2出现了异常现象(先变浑浊后又变澄清.提示:过量的CO2会与CaCO3等反应生成可溶于水的Ca(HCO3)2),兴趣小组同学利用数字分析仪进行研究,测定记录得到溶液的导电性变化随二氧化碳的质量关系如下图所示.下列说法不正确的是( )
向盛有饱和澄清石灰水的烧杯中持续通入CO2出现了异常现象(先变浑浊后又变澄清.提示:过量的CO2会与CaCO3等反应生成可溶于水的Ca(HCO3)2),兴趣小组同学利用数字分析仪进行研究,测定记录得到溶液的导电性变化随二氧化碳的质量关系如下图所示.下列说法不正确的是( )| A. | ab段溶液逐渐变浑浊,bd段溶液逐渐变澄清 | |
| B. | b点溶液溶液碱性最强 | |
| C. | bd段反应为:CaCO3+CO2+H2O═Ca(HCO3)2 | |
| D. | c点溶液中含有2种溶质,沉淀质量为15g |
 小明欲测定一瓶标签破损的稀盐酸的溶质质量分数,现取10g稀盐酸样品,将10%的NaOH溶液逐滴加入到药品中,边滴加边搅拌,随着NaOH溶液的加入,溶液的pH变化如图所示,试回答:
小明欲测定一瓶标签破损的稀盐酸的溶质质量分数,现取10g稀盐酸样品,将10%的NaOH溶液逐滴加入到药品中,边滴加边搅拌,随着NaOH溶液的加入,溶液的pH变化如图所示,试回答: