题目内容
9.实验室有一瓶长期暴露在空气中的氢氧化钠固体,某兴趣小组的同学对该样品的成分及含量进行了探究.【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解.
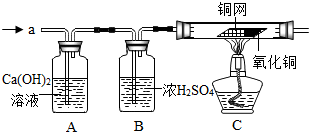
【实验探究一】为得到纯净的氢氧化钠固体,并测定NaOH的纯度,设计的实验过程如图1所示.请回答:

(1)操作B的名称为完善,加入适量某种试剂时反应的化学方程式是Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(选填“小于”、“等于”或“大于”)
(3)若要测定该固体中NaOH的纯度,实验过程中一定还需用到的仪器是托盘天平.
【实验探究二】为了测定NaOH的纯度,小红同学设计如图2装置(铁架台略去).
(4)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是CO2能溶于水,造成误差增大.
(5)实验中取用样品质量要控制在一定范围内,如果样品用量过多,会造成测定的NaOH纯度将偏小(选填“偏大”或“偏小”),原因中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大.
分析 (1)根据碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙和氢氧化钠,其中碳酸钙为固体解答;
(2)根据氢氧化钠变质是与二氧化碳反应生成碳酸钠和水,最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量解答;
(3)根据要测定该固体中NaOH的纯度,需要称量解答;
④根据实验目的“通过测二氧化碳的体积来计算药品中碳酸钠的含量”进行分析,
⑤根据装置内最终有残留的二氧化碳无法排尽,二氧化碳体积变小,所求碳酸钠质量变小,氢氧化钠固体质量变大解答;
⑥根据中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大解答.
解答 解:
(1)操作B将固体和液体分开,是过滤,
碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙和氢氧化钠,该反应的化学方程式是Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(2)根据反应看出,变质生成的碳酸钠通过反应生成氢氧化钠,最终所得氢氧化钠固体质量比变质后样品中氢氧化钠的质量多.
(3)若要测定该固体中NaOH的纯度,实验过程中一定还需用到的仪器是托盘天平;
(4)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的碳酸氢钠水溶液,可以避免二氧化碳的减少.
(5)中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大,会造成测定的NaOH纯度将偏小.
答案:
(1)过滤; Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(2)大于;
(3)托盘天平;
(4)CO2能溶于水,造成误差增大;
(5)偏小; 中和反应发热过多致使气体膨胀,计算碳酸钠的质量偏大.
点评 熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 酸雨的形成原理:CO2+H2O=H2CO3 | |
| B. | 利用赤铁矿炼铁:Fe3O4+4CO $\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | |
| C. | 不能用铁制容器配制波尔多液:2Fe+3CuSO4=Fe2(SO4)3+3Cu | |
| D. | 铜绿的形成:2Cu+O2+H2O+CO2═Cu2(OH)2CO3 |
| A. | 它是有机高分子化合物 | |
| B. | 其中氧元素与氢元素的质量比为9:1 | |
| C. | 其中碳元素的质量分数为51% | |
| D. | 一个丙烯酸分子由3个碳原子、4个氢原子和2个氧原子构成 |
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 水 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | H2O | Ca(OH)2 | Na2CO3 |
(2)利用表中的物质作为反应物,写出符合下列要求的化学方程式.
①电解水2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
②熟石灰和纯碱反应Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
(3)若要测定纯碱溶液的酸碱度,可选用下列选项中的③.
①无色酚酞试液 ②紫色石蕊试液 ③pH试纸
(4)槟榔芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列①来涂抹止痒.
①食醋(含醋酸) ②熟石灰 ③纯碱.
| A. |  滴加液体 | B. |  验满氧气 | C. |  读取液体体积 | D. |  稀释浓硫酸 |
 根据如图的原子结构示意图回答下列问题.
根据如图的原子结构示意图回答下列问题.