题目内容
4.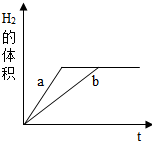 质量相等的铁和锌分别和质量相等,溶质质量分数也相等的稀盐酸反应,反应情况如图所示,则下列叙述中正确的是( )
质量相等的铁和锌分别和质量相等,溶质质量分数也相等的稀盐酸反应,反应情况如图所示,则下列叙述中正确的是( )| A. | 图线a、b分别表示铁、锌的反应情况 | B. | 盐酸均反应完,一定有铁剩余 | ||
| C. | 盐酸均反应完,一定有锌剩余 | D. | 锌、铁均反应完,盐酸有剩余 |
分析 在金属活动性顺序中,越靠前的金属金属活动性越强,和稀酸溶液反应时就越剧烈,则相同质量的金属和同质量、同溶质质量分数的稀酸溶液反应所需的时间也就越少.根据等质量金属完全反应放出氢气质量大小关系:Fe>Zn,若质量相等的锌、铁都完全反应,铁与酸反应放出氢气的量一定大于锌与酸的反应;
解答 解:由图示分析可知两者最终生成的氢气质量相等,所以消耗的酸量一定相等,也就是盐酸一定完全反应,而依据化学方程式的计算可知同质量的铁要比锌生成的氢气要多;
A、因为锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,因此a代表的是锌,故A错误;
B、由于得到的氢气一样多,说明稀盐酸全部参与反应,而这两种金属都有剩余或铁有剩余,故B正确;
C、由于得到的氢气一样多,说明稀盐酸全部参与反应,而这两种金属都有剩余或铁有剩余,故C错误;
D、由上可知因生成的气体一样多,所以稀盐酸全部参与反应,而铁一定有剩余,故D错误;
故选B.
点评 本题主要考查了金属的化学性质及其应用,掌握金属活动性顺序及其应用和酸的化学性质;学会利用化学方程式的计算来解决问题.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
15.下列实验中利用提供的方案能达到目的是B.
| 选项 | 实验目的 | 实验方案 |
| A | 除去铁粉中混有的少量银粉 | 用足量稀盐酸溶解后过滤 |
| B | 除去氧化钙中少量的碳酸钙 | 高温煅烧 |
| C | 收集氧气时,检验集气瓶是否集满 | 用燃着的木条伸入集气瓶中 |
| D | 证明分子在不断运动 | 将一滴红墨水滴入一杯清水中(合理即可) |
12.下列说法中一定正确的是( )
| A. | 有机物都含碳元素,含碳元素的物质都是有机物 | |
| B. | 酸和碱生成盐和水,有盐和水生成的反应一定是中和反应 | |
| C. | 两种化合物生成两种化合物的反应不一定是复分解反应 | |
| D. | 碱溶液显碱性,显碱性的溶液-定是碱溶液 |
13.生活中常接触到“含氟牙膏”、“碘盐”等物品,这里的“氟”、“碘”指的是( )
| A. | 元素 | B. | 分子 | C. | 原子 | D. | 单质 |

 传统干电池在日常生活中有多方面的应用,如图显示的是干电池的内部构造,请回答下列问题:
传统干电池在日常生活中有多方面的应用,如图显示的是干电池的内部构造,请回答下列问题:
