题目内容
2.下列物质的分类正确的是( )| A. | CO和C60都属于化合物 | B. | 氮气和氧气都属于非金属单质 | ||
| C. | H2O和C2H5OH都属于氧化物 | D. | 自来水和蒸馏水都属于纯净物 |
分析 纯净物由一种物质组成,混合物由两种或两种以上的物质组成;
单质是由一种元素组成的纯净物,化合物是由不同种元素组成的纯净物;
氧化物是由氧元素和另外一种元素组成的化合物.
解答 解:A、一氧化碳是由不同种元素组成的纯净物,属于化合物,C60是由一种元素组成的纯净物,属于单质;
B、氮气和氧气都是由一种非金属元素组成的纯净物,都属于非金属单质;
C、水是由氢元素和氧元素组成的化合物,属于氧化物,C2H5OH是由三种元素组成的化合物,不属于氧化物;
D、自来水中含有水和一些溶于水的物质,属于混合物,蒸馏水是由一种物质组成的,属于纯净物.
故选:B.
点评 判断纯净物和混合物时,就是判断物质的物质组成;判断是否是单质、化合物、氧化物时,既要判断元素组成,又要判断物质组成.

练习册系列答案
相关题目
4.分类法、类比分析法都是学习化学获取知识的重要科学方法.
(1)给定下列物质:H2、O2、CH4、CuO、CO2、CO对上述物质进行平均分成两类.其中一类是H2、CO、CH4;分类的依据是是否具有可燃性;
(2)比较比H2、CO、CH4均可作燃料,其中最理想的燃料是H2;比较还原性时,假设CH4有还原性,请写出在加热的条件下与CuO反应的化学方程式CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4Cu+2H2O.
(1)给定下列物质:H2、O2、CH4、CuO、CO2、CO对上述物质进行平均分成两类.其中一类是H2、CO、CH4;分类的依据是是否具有可燃性;
(2)比较比H2、CO、CH4均可作燃料,其中最理想的燃料是H2;比较还原性时,假设CH4有还原性,请写出在加热的条件下与CuO反应的化学方程式CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4Cu+2H2O.
| H2 | CO | CH4 | |
| 可燃性 | 有 | 有 | 有 |
| 还原性 | 有 | 有 | ? |
10.通过下列实验现象,能说明氢氧化钠与稀硫酸发生了化学反应的是( )
| A. | 在氢氧化钠溶液中先加入一定量的稀硫酸,再逐滴加入硫酸铜溶液,无明显现象 | |
| B. | 在pH=12的氢氧化钠溶液中加入一定量的稀硫酸,用pH计测得溶液的pH值变为9 | |
| C. | 在氢氧化钠溶液中先滴加无色酚酞,再逐滴加入稀硫酸,看到酚酞红色逐渐变浅 | |
| D. | 在稀硫酸中加入一定量的氢氧化钠固体,用温度计测得溶液的温度显著升高 |
17.下列4个图象能正确反映对应变化关系是( )
| A | B | C | D |
 |  |  |  |
| 向一定量的氢氧化钠溶液中滴加稀盐酸 | 木炭在盛有氧气的密闭容器内燃烧 | 将水通电电解一段时间 | 室温下,向不饱和硝酸钾溶液中加入硝酸钾 |
| A. | A | B. | B | C. | C | D. | D |
11. 一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )
一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )
 一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )
一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )| A. | 10m克 | B. | 24m克 | C. | 80m克 | D. | 无法确定 |
12.工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe2O4.
【查阅资料】1.草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CO2↑+CO↑+4H2O.
2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳.
3.铁的常见氧化物中铁的质量分数:
【问题讨论】为了测定铁红中铁的质量分数,小组同学进行如下实验.(装置气密性良好)
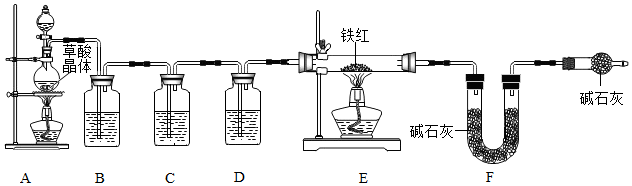
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是cba.(填字母序号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(2)C装置的作用是检验二氧化碳是否除尽.
(3)写出E装置中所发生反应的一个化学方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(或4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2或CO+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2).
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①若E中充分反应后得到铁粉的质量为mg,则7.0<m<7.78.
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是72%.
【实验反思】
(1)如果缺少装置G(不考虑其他因素),则测得样品中铁的质量分数会偏小(选填“偏小”“不变”或“偏大”).
(2)该实验装置的一个明显缺陷是缺少尾气处理装置.
【查阅资料】1.草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CO2↑+CO↑+4H2O.
2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳.
3.铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是cba.(填字母序号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(2)C装置的作用是检验二氧化碳是否除尽.
(3)写出E装置中所发生反应的一个化学方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(或4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2或CO+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2).
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①若E中充分反应后得到铁粉的质量为mg,则7.0<m<7.78.
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是72%.
【实验反思】
(1)如果缺少装置G(不考虑其他因素),则测得样品中铁的质量分数会偏小(选填“偏小”“不变”或“偏大”).
(2)该实验装置的一个明显缺陷是缺少尾气处理装置.