题目内容
4.(1)实验室里有一瓶未知浓度的氢氧化钠溶液,现用浓度为0.365%的稀盐酸来标定它.实验测得,标定该氢氧化钠溶液20.00mL,需要浓度为0.365%的稀盐酸5.00mL.求:该NaOH溶液的溶质质量分数.(假设本题所涉及到的各种稀溶液的密度均近似为1.0g•mL-1,且每滴液体的体积近似为0.05mL)(2)在盛有20mL该氢氧化钠溶液的锥形瓶中滴加2滴酚酞,再向瓶内缓缓倒入10mL0.365%的稀盐酸,锥形瓶内充分混合后溶液呈无色.若取该混合液3mL于一支试管中,再向其中滴入2滴该氢氧化钠溶液,试通过计算说明此时试管内溶液呈现的颜色.
分析 (1)根据氢氧化钠与盐酸反应的方程式结合氯化氢的质量计算氢氧化钠的质量,进一步计算该NaOH溶液的溶质质量分数.
(2)根据(1)信息可知“标定该氢氧化钠溶液20.00mL,需要浓度为0.365%的稀盐酸5.00mL.”进行分析;
解答 解:(1)稀盐酸的质量为5.00mL×1.0g•mL-1=5.00g,氢氧化钠溶液的质量为20.00mL×1.0g•mL-1=20.00g,
设该氢氧化钠溶液中氢氧化钠的质量为x
NaOH+HCl═NaCl+H2O,
40 36.5
x 5.00g×0.365%
$\frac{40}{x}=\frac{36.5}{5.00g×0.365%}$
x=0.02g
该NaOH溶液的溶质质量分数$\frac{0.02g}{20.00g}$×100%=0.1%
答:该NaOH溶液的溶质质量分数0.1%
(2)可知“标定该氢氧化钠溶液20.00mL,需要浓度为0.365%的稀盐酸5.00mL.”所以再向瓶内缓缓倒入10mL0.365%的稀盐酸,盐酸过量,溶液显酸性,酚酞为无色,当取3mL混合液时,其中剩余的氯化氢的质量为5g×0.365%×$\frac{3mL}{30mL}$=设2滴氢氧化钠溶液能中和的氯化氢质量为y,
NaOH+HCl═NaCl+H2O,
40 36.5
0.05g×2×0.1% y
$\frac{40}{0.05g×2×0.1%}=\frac{36.5}{y}$
y=9.125×10-5g<1.825×10-3g
所以盐酸有剩余,溶液为无色.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
19.下列实验操作正确的是( )
| A. |  取用氯化钠 | B. |  溶解氯化钠 | C. |  读取水的体积 | D. |  称取氯化钠 |
13.下列物质中,既能与水反应,它的水溶液又分别能跟铁、氯化钡、烧碱反应的是(( )
| A. | 盐酸 | B. | 三氧化硫 | C. | 氧化钙 | D. | 无水硫酸铜 |

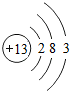 ,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.
,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.



 A~H是初中化学常见的物质,其中A为白色固体,E为黑色固体(一种金属氧化物),H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.(1)写出下列物质的化学式:ACaCO3,GCuSO4,HCu(OH)2.
A~H是初中化学常见的物质,其中A为白色固体,E为黑色固体(一种金属氧化物),H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.(1)写出下列物质的化学式:ACaCO3,GCuSO4,HCu(OH)2.