题目内容
3. 某硫酸铵[(NH4)2SO4]样品,可能含有少量的氯化铵[NH4Cl],为了测定硫酸铵样品中硫酸铵的质量分数,取样品16.0g,加入40.0g水中完全溶解后,向溶液中加入某种质量分数的氯化钡溶液,实验中精确测得产生白色沉淀的质量与加入氯化钡溶液的质量的关系如图所示.
某硫酸铵[(NH4)2SO4]样品,可能含有少量的氯化铵[NH4Cl],为了测定硫酸铵样品中硫酸铵的质量分数,取样品16.0g,加入40.0g水中完全溶解后,向溶液中加入某种质量分数的氯化钡溶液,实验中精确测得产生白色沉淀的质量与加入氯化钡溶液的质量的关系如图所示.试计算:
(1)硫酸铵中氢和氧元素的质量比为1:8.
(2)样品中硫酸铵的质量分数是多少?
(3)当恰好反应时,所得溶液中溶质的质量分数是多少?
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)由氯化钡和硫酸铵的反应,根据硫酸钡沉淀质量可求出硫酸氨的质量和生成氯化铵的质量,再求出样品中硫酸铵的质量分数.
(3)反应后所得溶液为氯化铵溶液,其溶质氯化铵由两部分组成:一部分为原混合物质中的氯化铵,另一部分则是反应生成的氯化铵;
解答 解:(1)硫酸铵中氢、氧两种元素的质量比为(1×8):(16×4)=1:8.故填:1:8;
(2)由图可知,生成硫酸钡沉淀的质量为2.33g,
设硫酸铵的质量为x,生成氯化铵的质量为y.
BaCl2+(NH4)2SO4═BaSO4↓+2NH4Cl
132 233 107
x 23.3g y
$\frac{132}{x}=\frac{233}{23.3g}=\frac{107}{y}$
解得:x=13.2g,y=10.7g
样品中硫酸铵的质量分数是:$\frac{13.2g}{16.0g}×100%$=82.5%.
(3)当恰好反应时,所得溶液中溶质的质量分数是$\frac{10.7g+(16.0g-13.2g)}{16.0g+40.0g+92.3g-23.3g}×100%$=10.8%
答:样品中硫酸铵的质量分数是82.5%.
(3)当恰好反应时,所得溶液中溶质的质量分数是10.8%.
点评 在解此类题时,关键是分析题中图象中转折点的含义和方式反应的原理,再根据比例关系解答.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
11.将Cu-Zn合金粉末放到盛有稀硫酸的烧杯中,恰好完全反应.相关实验数据如表:
(1)生成氢气的质量为0.04g.
(2)若不考虑该合金中除Cu、Zn以外的其它成分.请计算稀硫酸的溶质质量分数.
| Cu-Zn合金的质量/g | 稀硫酸的质量/g | 反应后烧杯内物质的总质量/g |
| 4.0 | 10 | 13.96 |
(2)若不考虑该合金中除Cu、Zn以外的其它成分.请计算稀硫酸的溶质质量分数.
18.下列图象与叙述对应正确的是( )


| A. | 将质量相等且足量的锌粉和铁粉分别投入相同质量、相同溶质质量分数的稀硫酸中 | |
| B. | 将一种稀硫酸均分成两份,分别向其中投入足量的氧化锌和碳酸锌 | |
| C. | 逐滴向一定量的氢氧化钠溶液中滴加稀盐酸直至过量 | |
| D. | 不断向稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液 |
12.除杂是化学实验的重要环节,下列实验方法能达到实验目的是( )
| 实验目的 | 实验方法 | |
| A | 除去CO中混有的少量CO2 | 通过灼热的氧化铜粉末 |
| B | 除去O2中混有的H2O | 将气体通过氢氧化钠溶液 |
| C | 除去KCl中混有的MnO2 | 加足量水溶解,过滤,蒸发结晶 |
| D | 除去KNO3溶液中混有的K2CO3 | 加入足量稀盐酸,充分反应后,蒸发结晶 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
13.下列关于“一定”的说法一定正确的是( )
| A. | 电离时不出现氢氧根离子的物质一定不呈碱性 | |
| B. | 金属活动性靠前的物质一定能将靠后的物质从它的溶液中置换出来 | |
| C. | 做功的过程中,一定实现能量的转化 | |
| D. | 酵母菌一定要在无氧环境中才能存活 |

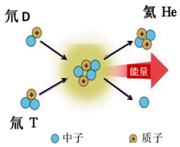 中科院的“人造太阳”EAST物理实验获重大突破,实验中首次实现持续时间达102秒的超高温长脉冲等离子体放电,为目前世界最长,其原理如图.
中科院的“人造太阳”EAST物理实验获重大突破,实验中首次实现持续时间达102秒的超高温长脉冲等离子体放电,为目前世界最长,其原理如图. 
 A-G是初中化学常见的物质.已知A是铁锈主要成分,D是可供给呼吸的气体,F是常用的溶剂,G可以用来改良酸性土壤.物质之间的相互反应及转化关系如图所示,图中“→”表示转化关系,“-”表示能相互反应.(部分反应物、生成物或反应条件已略去).
A-G是初中化学常见的物质.已知A是铁锈主要成分,D是可供给呼吸的气体,F是常用的溶剂,G可以用来改良酸性土壤.物质之间的相互反应及转化关系如图所示,图中“→”表示转化关系,“-”表示能相互反应.(部分反应物、生成物或反应条件已略去).