题目内容
14.如图是100mgCaC2O4•H2O受热分解时,所得固体产物的质量随温度变化的曲线.
试利用图中信息结合所学的知识,回答下列问题:
(1)温度分别为t1和t2,固体产物的化学式为:ACaC2O4,BCaCO3.
(2)由CaC2O4•H2O得到A的化学方程式为CaC2O4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaC2O4+H2O↑.
(3)由A得B的化学方程式为CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑.
(4)由图计算产物C的分子量,并推断C的合理的化学式.
分析 对图象进行分析,从图中曲线变化分析推出不同温度下发生的化学反应.
解答 解:根据题目要求可分3段讨论CaC2O4•H2O的受热分解.
??(1)t1时A点,100mgCaC2O4•H2O的质量减少至87.7mg,从中分析CaC2O4•H2O受热分解的产物,固体CaC2O4•H2O的摩尔质量为146g/mol,设分解后产物的摩尔质量为M1.
$\frac{100×1{0}^{-3}}{146g/mol}=\frac{87.7×1{0}^{-3}g}{{M}_{1}}$
M1=128.04g/mol
??由于CaC2O4的摩尔质量为128g/mol,从而判断出CaC2O4•H2O的分解反应方程式为:CaC2O4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaC2O4+H2O↑(1)
??A的化学式是CaC2O4.
??再讨论t2时B点,87.7mg的CaC2O4受热分解,设分解产物的摩尔质量为M2.
??$\frac{87.7×1{0}^{-3}g}{128g/mol}=\frac{68.5×1{0}^{-3}g}{{M}_{2}}$??M2=99.98g/mol
从M2的实验值可推断出产物B应为CaCO3,分解方程式为:
?CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑(2)
??(2)综上分析,由CaC2O4•H2O得到A的化学方程式即为CaC2O4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaC2O4+H2O↑
??(3)综上分析,由A得到B的化学方程式即为?CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑
??(4)当加热至1100℃~1200℃时,由图读得分解产物C的质量约为38mg,设C点化合物摩尔质量为M3.
?$\frac{68.5×1{0}^{-3}g}{100g/mol}=\frac{38×1{0}^{-3}g}{{M}_{3}}$?M3=55.47g/mol
??M3的实验值与CaO的摩尔质量(56g/mol)接近,分解方程式应为:
CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑(3)
??由此得出C的化学式为CaO,其分子量即为56.
故答案为:
(1)CaC2O4、CaCO3;
(2)CaC2O4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaC2O4+H2O↑;
(3)CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑;
(4)CaO.
点评 本题通过固体受热分解曲线的图象告诉我们做化学题时一定要重视化学过程,从而培养化学意识,提高化学素质.

| A. | CO2、O2、N2,三种无色气体(燃着的木条) | |
| B. | 稀H2SO4、Ca(OH)2、NaCl,三种无色溶液(石蕊溶液) | |
| C. | NaOH、Na2CO3、CaCO3,三种白色固体(水) | |
| D. | CuO、C、Fe,三种黑色粉末(稀硫酸) |
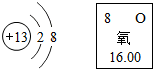 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐渐加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
| A. | 未说明药品用量时,液体取5mL左右,固体只需盖满试管底部 | |
| B. | 用滴管滴加液体时,为防止液滴飞溅应将滴管口紧贴试管内壁 | |
| C. | 酒精灯用完后,立即用嘴吹灭,并盖上灯帽,以防酒精挥发,下次使用时易点燃 | |
| D. | 玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表示仪器洗涤干净 |
 小明设计了一个趣味喷泉实验装置(如图),其气密性良好.但实验时,当将A中的固体和液体混合后,B中尖嘴导管处并没有有“喷泉”产生.请你分析:A中加入的固体和液体可能是( )
小明设计了一个趣味喷泉实验装置(如图),其气密性良好.但实验时,当将A中的固体和液体混合后,B中尖嘴导管处并没有有“喷泉”产生.请你分析:A中加入的固体和液体可能是( )| A. | 碳酸钠和盐酸 | B. | 氯化钡和稀硫酸 | ||
| C. | 二氧化锰和过氧化氢溶液 | D. | 锌粉和稀硫酸 |
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 8 | 1 | 36 | 10 |
| 反应后质量(g) | 待测 | 20 | 0 | 31 |
| A. | 甲待测的质量值为4 | B. | 该反应的类型不可能是分解反应 | ||
| C. | 该反应的类型可能是化合反应 | D. | 该反应遵守质量守恒定律 |
 所表示的粒子是( )
所表示的粒子是( )| A. | 分子 | B. | 阴离子 | C. | 阳离子 | D. | 原子 |
