题目内容
16.如图1为甲、乙(均不含结晶水)两种固体物质的溶解度曲线.(1)t2℃时,乙的溶解度是15g.
(2)某同学在t1℃时开始进行如图2实验,在烧杯A、B、C中属于饱和溶液的是B(填编号).
(3)图2中,B、C两烧杯中甲的溶质质量分数大小关系是B<C(填>、<或=).

分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,t2℃时,乙的溶解度是15g;
(2)t1℃时,甲物质的溶解度是20g,t2℃时,甲物质的溶解度是40g,某同学在t1℃时开始进行如图2实验,在烧杯A、B、C中属于饱和溶液的是B;
(3)t1℃时,甲物质的溶解度是20g,t2℃时,甲物质的溶解度是40g,B的烧杯底部有固体,C中完全溶解,所以图2中,B、C两烧杯中甲的溶质质量分数大小关系是B<C.
故答案为:(1)15g;
(2)B;
(3)<.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
6.氨碱法生产纯碱的主要反应原理如下:(1)NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl
(2)2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.对上述信息的有关理解错误的是( )
(2)2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.对上述信息的有关理解错误的是( )
| A. | 用食盐制纯碱需要含碳、氧元素的物质 | |
| B. | 氨盐水比食盐水更易吸收二氧化碳 | |
| C. | (1)中析出晶体后剩余溶液中只有一种溶质 | |
| D. | 碳酸氢钠比碳酸钠受热更易分解 |
7.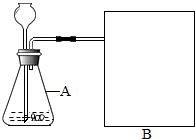 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间.
【进行实验】:图示是他们进行实验的装置图.气体发生装置中A仪器的名称是:锥形瓶,此实验中B处宜采用的气体收集方法是排水法.
【结论】该探究过程得出的结论相同条件下,H2O2生成O2的快慢与催化剂的种类有关.
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否变.
 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间.
【进行实验】:图示是他们进行实验的装置图.气体发生装置中A仪器的名称是:锥形瓶,此实验中B处宜采用的气体收集方法是排水法.
| 试验编号 | 1 | 2 |
| 反应物 | 6%的过氧化氢 | 6%的过氧化氢 |
| 催化剂 | 1g红砖粉 | 1g二氧化锰 |
| 时间 | 152s | 35s |
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否变.
11.下列说法正确的是( )
| A. | 10g氢气与10g氧气在一定条件下反应,生成水的质量为20g | |
| B. | 50ml酒精中加入50ml水,所得酒精溶液的体积为100ml | |
| C. | 5%的氯化钠溶液与10%的氯化钠溶液等质量混合,得到15%的氯化钠溶液 | |
| D. | 某物质在氧气中充分燃烧生成二氧化碳和水,该物质一定含有碳、氢两种元素 |
1.有一包白色粉末,由NH4Cl、Na2CO3、NaCl、CaCO3中的两种组成,为确定其成分,小刚同学进行了如下探究:
(1)收集到以下可能用到的相关资料
[资料1]部分物质的溶解性表
[资料2]铵盐能与碱反应,放出氨气.
(2)探究一:取样品溶于足量的水中,样品全部溶解,则白色粉末中一定无CaCO3.
(3)探究二:[提出猜想]得到的溶液中可能含有的溶质是:
猜想1:Na2CO3和NaCl
猜想2:NH4Cl和NaCl
猜想3:NH4Cl和Na2CO3
[实验验证](将下表中的①②③处填写完整)
[实验反思]某同学认真研究了探究过程,认为“探究二”只需要使用一种试剂,一步就能得出结论.你认为这种试剂可能是Ca(OH)2(填化学式).
(1)收集到以下可能用到的相关资料
[资料1]部分物质的溶解性表
| 阴离子 | OH- | Cl- | CO32- |
| 阳离子 | |||
| Ca2+ | 微 | 溶 | 不 |
| NH4+ | 溶、挥 | 溶 | 溶 |
(2)探究一:取样品溶于足量的水中,样品全部溶解,则白色粉末中一定无CaCO3.
(3)探究二:[提出猜想]得到的溶液中可能含有的溶质是:
猜想1:Na2CO3和NaCl
猜想2:NH4Cl和NaCl
猜想3:NH4Cl和Na2CO3
[实验验证](将下表中的①②③处填写完整)
| 步骤 | 实验操作 | 实验现象 | 相应的结论 |
| 一 | 取样,加入稀盐酸 | ①有气泡产生 | 猜想2不成立 |
| 二 | ②加入氢氧化钠溶液 | 有刺激性气味气体生成 | 猜想③,成立 |
8.下列方法中,能达到目的是C.
| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | NaOH溶液(Na2SO4) | 加入适量的BaCl2溶液、过滤 |
| B | CaO(CaCO3) | 加水溶解、过滤 |
| C | CO(CO2) | 通过足量氢氧化钠溶液,并干燥 |
| D | CuSO4溶液(H2SO4) | 加入过量的氧化铜,充分反应后过滤 |
6.下列鉴别物质的方法错误的是( )
| A. | 用闻气味的方法鉴别白酒和白醋 | B. | 用酚酞鉴别食盐水和稀醋酸 | ||
| C. | 用水鉴别生石灰和石灰石 | D. | 用BaCl2溶液鉴别稀硫酸和稀盐酸 |

