题目内容
2. 化学是一门以实验为基础的科学,实验是学习化学的一条重要途径.根据以下实验解答下列问题:
化学是一门以实验为基础的科学,实验是学习化学的一条重要途径.根据以下实验解答下列问题:(1)如图是测定空气中氧气含量的实验装置.实验中能得出“氧气约占空气总体积五分之一”结论的实验现象是冷却后,打开止水夹,吸入瓶中的水大约上升五分之一.
(2)若装置的气密性良好,去掉烧杯,点燃红磷,在装置完全冷却后,打开弹簧夹,装置的总质量会增加(填“增加”、“减少”或“不变”),该实验中的变化文字表达式是磷+氧气$\stackrel{点燃}{→}$五氧化二磷.
分析 (1)根据红磷燃烧的现象得出氧气约占空气总体积五分之一的结论;
(2)根据红磷的燃烧消耗氧气生成五氧化二磷固体进行分析.
解答 解:(1)在测定空气中氧气含量的实验中,根据现象“冷却后,打开止水夹,吸入瓶中的水大约上升五分之一”可得出“氧气约占空气总体积五分之一”的结论.
故答案为:冷却后,打开止水夹,吸入瓶中的水大约上升五分之一;
(2)红磷燃烧生成P2O5固体,固体的质量大于消耗的红磷质量,且打开弹簧夹后空气进入瓶中,补充消耗的氧气,因此点燃红磷,在装置完全冷却后,打开弹簧夹,装置的总质量会增加.该实验中的变化文字表达式是:磷+氧气$\stackrel{点燃}{→}$五氧化二磷.
故答案为:
(1)冷却后,打开止水夹,吸入瓶中的水大约上升五分之一;
(2)增加;磷+氧气$\stackrel{点燃}{→}$五氧化二磷.
点评 熟练掌握测定空气中氧气含量实验的过程、注意问题、会分析实验现象得出结论是解答本题关健.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
13.下列实验操作中错误的是( )
| A. |  蒸发结晶 | B. |  检查气密性 检查气密性 | ||
| C. |  试管用后不清洗直接插入液体 | D. |  塞紧橡皮塞 |
10.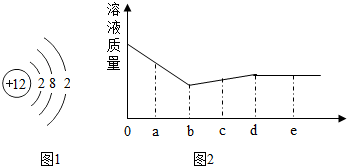 某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
(1)图1是镁原子的结构示意图.下列说法不正确的是AD.
A 镁原子的核外电子数为2
B 在化合物中镁通常显+2价
C 镁在空气中燃烧发出耀眼白光
D 镁是地壳中含量最多的金属元素
(2)铝制品比较耐腐蚀,其原因是铝和氧气反应生成一层致密的氧化铝薄膜,对自身起到了保护作用.相同铁制品在沿海地区比在沙漠地区生锈更快的原因是沿海地区比沙漠地区空气潮湿,铁在潮湿的空气中易生锈.
(3)向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,充分反应,所得溶液质量与加入锌的质量关系如图2所示.
①当锌的质量为ag时,溶液中一定含有的溶质有Zn(NO3)2、AgNO3、Cu(NO3)2(填“化学式”).
②当锌的质量为bg时,溶液呈蓝色.
③当锌的质量为eg时,过滤得到固体,可通过以下实验探究固体的成分,请将下表填写完整.
④实验室用锌和酸反应可以制取氢气,金属钠可以与氢气发生反应,反应的化学方程式为:H2+2Na$\frac{\underline{\;\;△\;\;}}{\;}$2NaH,以实现氢气的储存.请计算若用230g金属钠吸收氢气,理论上需要金属锌的质量是多少?
 某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.
某活动小组的同学研究了一些常见金属的结构、性质、用途和变化规律等.(1)图1是镁原子的结构示意图.下列说法不正确的是AD.
A 镁原子的核外电子数为2
B 在化合物中镁通常显+2价
C 镁在空气中燃烧发出耀眼白光
D 镁是地壳中含量最多的金属元素
(2)铝制品比较耐腐蚀,其原因是铝和氧气反应生成一层致密的氧化铝薄膜,对自身起到了保护作用.相同铁制品在沿海地区比在沙漠地区生锈更快的原因是沿海地区比沙漠地区空气潮湿,铁在潮湿的空气中易生锈.
(3)向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,充分反应,所得溶液质量与加入锌的质量关系如图2所示.
①当锌的质量为ag时,溶液中一定含有的溶质有Zn(NO3)2、AgNO3、Cu(NO3)2(填“化学式”).
②当锌的质量为bg时,溶液呈蓝色.
③当锌的质量为eg时,过滤得到固体,可通过以下实验探究固体的成分,请将下表填写完整.
| 实验步骤 | 现象 | 化学方程式 |
| 取少量固体样品,加稀盐酸 | 有无色气味气体生成 | Zn+2HCl=ZnCl2+H2↑ |
17.在世界范围内,污染空气的主要气体是( )
| A. | 氮气、二氧化硫、二氧化氮 | B. | 二氧化碳、二氧化硫、二氧化氮 | ||
| C. | 水蒸气、二氧化硫、二氧化氮 | D. | 一氧化碳、二氧化硫、二氧化氮 |
14.下列过程中发生化学变化的是( )
| A. | 石墨导电 | B. | 将石墨转化成金刚石 | ||
| C. | 干冰升华成二氧化碳气体 | D. | 金刚石切割大理石 |
 卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品.现按下列步骤对卤水进行处理,试根据有关物质的溶解度曲线(如图所示)回答下列问题:
卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品.现按下列步骤对卤水进行处理,试根据有关物质的溶解度曲线(如图所示)回答下列问题: 碳和碳的部分化合物间的部分转化关系如图所示:
碳和碳的部分化合物间的部分转化关系如图所示: