题目内容
6. 多角度认识物质的变化,有助于我们更好地理解化学知识.我们借用如图装置分别进行下列实验,认识物质变化中的能量变化:
多角度认识物质的变化,有助于我们更好地理解化学知识.我们借用如图装置分别进行下列实验,认识物质变化中的能量变化:(1)往烧杯中加入一定量生石灰会引起白磷燃烧,从燃烧条件分析,此时生石灰的作用是生石灰与水反应放出大量的热,水温升高,达到了白磷的着火点.写出生石灰与水反应的化学方程式CaO+H2O═Ca(OH)2.
(2)将一定量的下列某物质溶于烧杯中的冷水,其中能引起白磷燃烧的是CD(填标号).
A.氯化钠 B.硝酸铵 C.浓硫酸 D.氢氧化钠.
分析 (1)根据生石灰与水的反应分析回答;
(2)物质溶于烧杯中的冷水,能引起白磷燃烧,说明了物质在溶于水时能放出热量,据此分析.
解答 解:(1)往烧杯中加入一定量生石灰会引起白磷燃烧,从燃烧条件分析,此时生石灰的作用是:生石灰与水反应放出大量的热,水温升高,达到了白磷的着火点.生石灰与水反应的化学方程式是:CaO+H2O═Ca(OH)2.
(2)将一定量的下列某物质溶于烧杯中的冷水,能引起白磷燃烧,说明了物质在溶于水时能放出热量,浓硫酸、氢氧化钠在溶于水时能放出热量,能使溶液的温度升高.
故答案为:生石灰与水反应放出大量的热,水温升高,达到了白磷的着火点,CaO+H2O═Ca(OH)2;②CD
点评 本题考查了燃烧的条件,明确物质溶于水或与水反应是否放热来分析.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
7.物质是由分子、原子等微粒构成的.用分子的相关知识解释下列现象,正确的是( )
| A. | 缉毒犬能根据气味发现毒品,是由于分子在不断运动 | |
| B. | 変瘪的乒乓球放入热水中能鼓起来,是由于分子间隔变大 | |
| C. | 水降温会结冰,是因为结冰时水分子静止不动 | |
| D. | 将石块研磨成粉状,说明分子变小了 |
14.下列特产制作的主要过程中涉及化学变化的是( )
| A. | 奉节脐橙榨汁 | B. | 缙云竹笋晾干 | C. | 梁平金柚酿酒 | D. | 湛江海椒磨粉 |
1. 锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )
锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )
 锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )
锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )| A. | 锡元素的符号是Sn | B. | 锡原子的相对原子质量是118.7 | ||
| C. | 锡原子核外电子数是50 | D. | 锡元素属于非金属元素 |
18.根据如图水分子分解的微观示意图,得出的信息错误的是( )
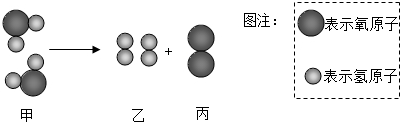

| A. | 反应前后分子的数目发生改变 | |
| B. | 反应前后分子的种类发生改变 | |
| C. | 分子是化学变化中的最小微粒 | |
| D. | 甲、乙、丙三种分子的个数比为2:2:1 |
15.实验探究是化学的灵魂,请你参与实验室制取氧气和二氧化碳的探究活动.
Ⅰ.制取氧气方法的分析
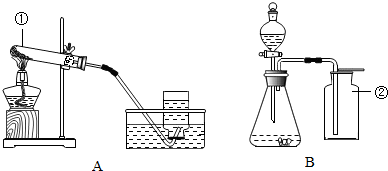
(1)写出A、B装置中标号仪器名称:①试管;②集气瓶.
(2)写出一个用A或B装置制取氧气的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若用B装置制取一瓶氧气,验满的方法是将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.
(4)上述两种方法中,更符合“低碳”理念的是B(填“A”或“B”).
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
[分析一]实验室不能(填“能”或“不能”)用稀硫酸与块状石灰石反应制取二氧化碳.
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
[分析二]实验室不选用石灰石粉末、碳酸钙粉末或碳酸钠粉末制取二氧化碳的理由是反应速率太快,不利于二氧化碳的收集.
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有反应速率快慢(写一种即可).
Ⅰ.制取氧气方法的分析

(1)写出A、B装置中标号仪器名称:①试管;②集气瓶.
(2)写出一个用A或B装置制取氧气的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若用B装置制取一瓶氧气,验满的方法是将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.
(4)上述两种方法中,更符合“低碳”理念的是B(填“A”或“B”).
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
| 实验步骤 | 实验现象 |
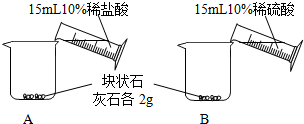 | A中不断产生气泡,固体逐渐减少,有少量固体剩余. B中开始有少量气泡产生,反应很快停止. |
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
| 实验步骤 | 实验现象 |
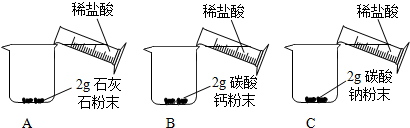 | A中迅速产生大量气泡,固体很快减少,有少量固体剩余. B、C中都迅速产生大量气泡,固体很快消失. |
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有反应速率快慢(写一种即可).
16.2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS)的物质.已知硫化羰的结构与二氧化碳相似,能在空气中燃烧.下列有关硫化羰的说法正确的是( )
| A. | 硫化羰可用来灭火 | |
| B. | 硫化羰是氧化物 | |
| C. | 相同分子数的硫化羰与二氧化碳比较,硫化羰质量小 | |
| D. | 如果硫化羰中碳元素的化合价为+4,则硫元素的化合价为-2 |