题目内容
8.某厂生产纳米碳酸钙的主要流程如图:
(1)该工艺中生成CaCO3的反应中CaCl2与NH4Cl化学计量数之比为1:2.
(2)若在实验室中进行该实验,操作1的名称是过滤,使用到的玻璃仪器有玻璃棒、烧杯、漏斗.
(3)操作2为洗涤、干燥,目的是除去碳酸钙粗品表面含有的可溶性杂质,检验是否洗涤干净的方法是:向最后一次洗涤液中加入②溶液(①Ca(OH)2、②AgNO3、③CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净.
分析 (1)根据方程式的写法考虑;
(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;
(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑.
解答 解:(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,化学方程式为:CaCl2+2NH3•H2O+CO2=CaCO3↓+2NH4Cl+H2O,故反应中CaCl2与NH4Cl化学计量数之比为:1:2故填:1:2;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;故填:漏斗;
(3)由于碳酸钙粗品是从氯化氨溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙,检验是否含有氯化铵或氯化钙,可以利用检验氯离子的方法,使用硝酸银,银离子能与氯离子生成氯化银沉淀,有沉淀说明没有除尽,没有沉淀说明除尽了,故选②.
点评 在解此类题时,首先分析反应流程中各个步骤的作用,然后结合学过的知识和题中的条件进行分析解答.

练习册系列答案
相关题目
3.比较、推理是化学学习常用的方法.以下推理不合理的是( )
| 序号 | 化学反应事实 | 影响反应的因素 |
| A | 二氧化碳常温下与水反应,生成碳酸,光合作用时则生成葡萄糖 | 反应条件 |
| B | 碳在常温下不与氧气反应,而在点燃时能与氧气反应 | 反应温度 |
| C | 双氧水在常温下较难分解,而在加入二氧化锰后迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,铜粉在空气中较易燃烧 | 反应物的种类 |
| A. | A | B. | B | C. | C | D. | D |
1.下列变化属于化学变化的是( )
| A. | 粗盐(含不溶于水的杂质)提纯 | B. | 用金刚石刻划玻璃 | ||
| C. | 冰融化成水 | D. | 充分加热试管中的火柴头使其燃烧 |


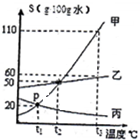 如图是甲、乙、并三种固体物质的溶解度曲线.
如图是甲、乙、并三种固体物质的溶解度曲线.
 国家环保总局已规定将各类实验室纳入环保监管范围.某中学九年级甲、乙两个班的同学分别做常见酸和碱与指示剂反应的实验,所做的实验和使用的试剂如图所示.实验后废液分别集中到各班的废液缸中,甲班废液呈红色,乙班废液呈蓝色.
国家环保总局已规定将各类实验室纳入环保监管范围.某中学九年级甲、乙两个班的同学分别做常见酸和碱与指示剂反应的实验,所做的实验和使用的试剂如图所示.实验后废液分别集中到各班的废液缸中,甲班废液呈红色,乙班废液呈蓝色.