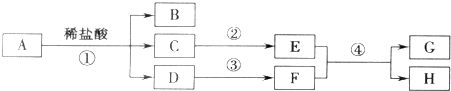
题目内容
6.把氯气通入水中,氯气和水反应生成盐酸和次氯酸(HClO),次氯酸是一种强氧化剂,具有漂白性,能杀死水里的细菌,不稳定见光易分解等性质.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中.当滴到最后一滴时红色突然褪去.产生上述现象的原因可能有哪两种?简述怎样用实验证明红色褪去的原因?分析 根据氯气能与水发生化学反应生成盐酸和次氯酸(HClO),次氯酸具有强氧化性,可将某些有色物质氧化成无色物质;盐酸与氢氧化钠溶液会发生中和反应;利用继续加碱的方法,红色不恢复,说明是次氯酸的作用进行分析.
解答 解:由题意分析,原因可能有两个:盐酸或次氯酸的作用的结果,次氯酸具有强氧化性,可将某些有色物质氧化成无色物质;氯水中的盐酸、次氯酸中和了氢氧化钠,使溶液由碱性转变成了中性甚至酸性,酚酞试液中性或酸性溶液中显无色;为证明红色褪去的原因,可继续向溶液中加氢氧化钠溶液,若红色不恢复,说明是次氯酸的作用;
故答案为:一种可能是:溶液中的红色物质被氯水中的次氯酸氧化褪色;另一种可能是:氯水中的盐酸、次氯酸中和了氢氧化钠,使溶液由碱性转变成了中性甚至酸性,酚酞试液中性或酸性溶液中显无色;继续向溶液中加氢氧化钠溶液,若红色不恢复,说明是次氯酸的作用.
点评 本题难度较大,考查同学们新信息获取、处理及灵活运用所学知识的能力,还考查了化学方程式的书写和中和反应,综合性比较强,培养了同学们的语言表达能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.物质发生化学变化时,会伴随发光、放热、变色、放出气体或出现沉淀等现象,这些现象可以帮助我们判断有没有发生化学变化,如表有五位同学的错误观点,请你用熟悉的日常事例来否定其错误观点.
| 同学 | 错误观点 | 否定例证 |
| 甲 | 有发光现象发生的变化一定是化学变化 | 电灯发光发热属于物理变化 |
| 乙 | 有放热现象发生的变化一定是化学变化 | 浓硫酸溶于水放热,属于物理变化 |
| 丙 | 有颜色改变现象发生的变化一定是化学变化 | 氧气加压降温变成淡蓝色液体,属于物理变化 |
| 丁 | 有气体放出现象发生的变化一定是化学变化 | 水加热变成水蒸气,属于物理变化 |
| 戊 | 有沉淀现象发生的变化一定是化学变化 | 熟石灰溶于水,底部有固体 |
4.“泡沫铝”是轻质多孔泡沫铝合金的简称,它除了具有隔音、隔热等优良性能外,同时还具有金属铝固有的防潮、耐蚀等性能.你认为该材料具有耐蚀性质的原因是( )
| A. | 泡沫铝的多孔结构 | |
| B. | 铝的金属活动性比较差 | |
| C. | 铝的表面有泡沫成分使铝与外界隔绝 | |
| D. | 金属铝易与氧气发生反应产生致密的氧化膜 |
 空气是人类宝贵的自然资源.
空气是人类宝贵的自然资源.