题目内容
17.如图是实验室常用的一些装置.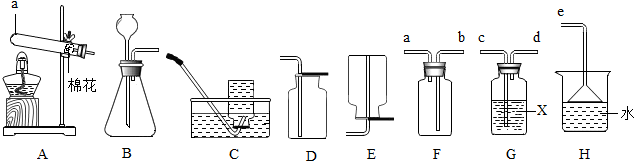
(1)仪器a的名称是试管;
(2)实验室制取并收集二氧化碳气体应选择的装置是BD(填序号);
(3)用装置A与C连接制取并收集氧气,则装置A中反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)SO2通常是一种无色有刺激性气味的有毒气体,密度比空气大,易溶于水,排放到空气中会形成酸雨.实验室用图装置收集一瓶干燥的SO2,装置的导管按气流方向连接 的顺序是c→d→b→a→e(填字母).
分析 (1)据常用仪器回答;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,故选固液常温型的发生装置,二氧化碳能够溶于水,密度比空气大;
(3)高锰酸钾受热时分解生成锰酸钾、二氧化锰和氧气,据此书写方程式;
(4)收集一瓶干燥的SO2,则须先将气体干燥,再收集,因为二氧化硫有毒、易溶于水,还要对尾气进行吸收处理,浓硫酸具有吸水性,可以用作某些气体的干燥剂.
解答 解:(1)仪器a是作为反应容器的试管;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,故选固液常温型的发生装置B,二氧化碳能够溶于水,密度比空气大,所以用向上排空气法收集;
(3)高锰酸钾受热时分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)收集一瓶干燥的SO2,则须先将气体干燥,再收集,因为二氧化硫有毒、易溶于水,还要对尾气进行吸收处理;所以要通过c导管把二氧化硫导入盛有浓硫酸的试剂瓶中进行干燥,通过d导管导出后,因为二氧化硫密度比空气大,所以通过b导管导入集气瓶中收集,为了防止二氧化硫逸出扩散到空气中污染环境,应该把a导管连接到e导管上,通过水吸收逸出的二氧化硫;
故答案为:(1)试管;
(2)BD;
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)c→d→b→a→e.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,洗气装置中导管要长进短出,双导管收集密度比空气大的气体,应从长导管进气,短导管便于排尽空气,发生装置据反应物的状态和反应条件进行选择,收集装置据气体的密度和溶解性进行选择.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 复合材料 | B. | 合成材料 | C. | 金属材料 | D. | 非金属材料 |
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 水 | 熟石灰 | 小苏打 |
| 化学式 | CH3COOH | H2O | Ca(OH)2 | NaHCO3 |
(2)表中的物质属于氧化物的是②.(用序号表示)
(3)若要比较精确地测定醋酸溶液的酸碱度,可选用下列选项中的④.(用序号表示)
①无色酚酞试液 ②紫色石蕊试液 ③pH试纸 ④pH计.
| A. | Ba(NO3)2→BaSO4 | B. | H2SO4→HCl | C. | CuO→Cu(OH)2 | D. | Ba(OH)2→Fe(OH)3 |
单质$\stackrel{氧气}{→}$氧化物$\stackrel{水}{→}$酸或碱$\stackrel{碱或酸}{→}$盐.
| A. | 甲烷 | B. | 镁 | C. | 硫 | D. | 铁 |
小明又思考新的问题,加氯化钠后,石灰石能与硫酸较快地发生反应,在反应中起促进作用是Na+、还是Cl-,还是二者共同作用的结果呢?然后设计了如下实验:向5支试管里各加入一块石灰石和5ml浓度为50%的硫酸,待反应停止后,再分别加入约0.2克的KCl、NH4Cl、CaCl2、…等固体轻轻振荡.观察到的现象记录于下表:
| 物质 | KCl | NH4Cl | CaCl2 | ① |
| 现象 | 继续发生反应生成二氧化碳气体,但反应较慢,反应一段时间后就趋于停止. | CaCl2溶解并生成大量的白色固体,但不能继续发生反应 | 没有明显 可见的现象 | |
(2)小明为了验证Na+在实验中的作用,在上表①处应加入的物质是Na2SO4或NaNO3;
(3)通过实验可得出的结论是加快石灰石与硫酸反应是Na+与Cl-共同起作用,Cl-所起的用比Na+大,钙离子对该反应起抑制作用;或加快石灰石与硫酸反应是Na+与Cl-共同起作用,Cl-所起的用比Na+大;或加快石灰石与硫酸反应是Na+与Cl-共同起作用,钙离子对该反应起抑制作用(只答加快石灰石与硫酸反应是Na+与Cl-共同起作用即可).
 硝酸铵[NH4NO3]是农业上常用的一种氮肥,用来为植物提供所需的氮元素.
硝酸铵[NH4NO3]是农业上常用的一种氮肥,用来为植物提供所需的氮元素.


