题目内容
(1)人类的生活离不开金属材料.生活中某些食品包装内放一小包铁粉,作用是什么?
(2)某同学在探究铝与稀盐酸的反应时,发现打磨过的铝片反应比未打磨过的铝片反应剧烈,请解释原因可能是什么?
(3)将一定量的锌粉加入到氯化亚铁和氯化铜的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.请分析滤液中所含溶质情况?
(2)某同学在探究铝与稀盐酸的反应时,发现打磨过的铝片反应比未打磨过的铝片反应剧烈,请解释原因可能是什么?
(3)将一定量的锌粉加入到氯化亚铁和氯化铜的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.请分析滤液中所含溶质情况?
考点:金属锈蚀的条件及其防护,金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)铁粉生锈,吸收氧气和水分;
(2)化学反应速率与药品的接触面积有关;(3)根据金属活动顺序表知锌>铁>H>铜,所以加入锌粉,首先锌粉和氯化铜溶液反应,置换出单质铜,如果锌粉足量可以再继续和氯化亚铁反应置换出铁.
(2)化学反应速率与药品的接触面积有关;(3)根据金属活动顺序表知锌>铁>H>铜,所以加入锌粉,首先锌粉和氯化铜溶液反应,置换出单质铜,如果锌粉足量可以再继续和氯化亚铁反应置换出铁.
解答:解:(1)铁粉生锈,吸收氧气和水分,能够防止食品变质和吸潮变软;
(2)增大了与稀盐酸的接触面积,故反应速率加快;
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生,说明固体没有铁和锌,则滤液中一定含有的溶质是FeCl2、ZnCl2;只有锌和氯化铜反应生成了氯化锌和铜,如果所加锌的量非常少,有可能氯化铜也会剩余下来.
故答案:(1)铁粉生锈,吸收氧气和水分,能够防止食品变质和吸潮变软;
(2)增大了与稀盐酸的接触面积,故反应速率加快;
(3)一定含有FeCl2、MgCl2,可能含有CuCl2.
(2)增大了与稀盐酸的接触面积,故反应速率加快;
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生,说明固体没有铁和锌,则滤液中一定含有的溶质是FeCl2、ZnCl2;只有锌和氯化铜反应生成了氯化锌和铜,如果所加锌的量非常少,有可能氯化铜也会剩余下来.
故答案:(1)铁粉生锈,吸收氧气和水分,能够防止食品变质和吸潮变软;
(2)增大了与稀盐酸的接触面积,故反应速率加快;
(3)一定含有FeCl2、MgCl2,可能含有CuCl2.
点评:本题主要考查了学生对金属活动顺序表的运用以及半定量(如一定量、过量、少量等)概念的理解和掌握.

练习册系列答案
相关题目

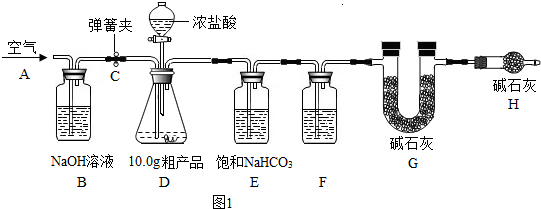
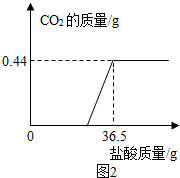
 自翔同学在整理厨房时不小心将一瓶醋打翻,醋洒在火炉旁的一堆草木灰上,发现有大量的气泡生成.激发了兴趣,于是他决定与学习小组的同学对草木灰的成分进行探究.
自翔同学在整理厨房时不小心将一瓶醋打翻,醋洒在火炉旁的一堆草木灰上,发现有大量的气泡生成.激发了兴趣,于是他决定与学习小组的同学对草木灰的成分进行探究.