题目内容
9. 根据标签求:
根据标签求:①葡萄糖酸钙中氢、碳、氧原子的个数比为11:6:7,质量比为11:72:112
②葡萄糖酸钙的相对分子质量为430.
③纯葡萄糖酸钙中钙的质量分数为9.3%
④请根据计算判断这种说法是否科学?
⑤成年人每天需克0.8钙,其中0.6克钙可从食物中获得,则他每天需补充多少克葡萄糖酸钙?
分析 ①根据化学式的意义进行分析计算即可;
②根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
③根据化合物中元素的质量分数的计算方法来分析.
④根据③的计算判断.
⑤根据题意,一个人正常情况下每天约需0.8g钙.如果每天从食物中得到0.6g钙,则每天从葡萄糖酸钙中补充0.2g钙,据此结合化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:①葡萄糖酸钙的化学式为(C6H11O7)2Ca,其中氢、碳、氧原子的个数比为(11×2):(6×2):(7×2)=11:6:7;氢、碳、氧元素的质量比为:(1×11×2):(12×6×2):(16×7×2)=11:72:112;故填:11:6:7;11:72:112;
②葡萄糖酸钙的相对分子质量为40+(12×6+1×11+16×7)×2=430.故填:430;
③葡萄糖酸钙中钙元素的质量分数为$\frac{40}{430}×100%$≈9.3%.故填:9.3%.
④由于纯净的葡萄糖酸钙中钙元素的质量分数为9.3%<9.5%,所以这种说法不科学.故填:不科学.
⑤由题意,一个人正常情况下每天约需0.8g钙.如果每天从食物中得到0.6g钙,
则每天从葡萄糖酸钙中补充0.2g钙.
每天应补充葡萄糖酸钙[(C6H11O7)2Ca]的质量为0.2g÷($\frac{40}{430}×100%$)=2.15g
答:每天应补充葡萄糖酸钙2.15g.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
13.下列变化过程不是化学反应的是( )
| A. | 燃放烟花 | B. | 干冰升华 | C. | 动物呼吸 | D. | 燃煤发电 |
20.指出下列溶液中溶质与溶剂
| 1 | 溶质 | 溶剂 |
| 氢氧化钠溶液 | 氢氧化钠 | 水 |
| 碘酒 | 碘 | 酒精 |
| 盐酸 | 氯化氢 | 水 |
| 石灰水 | 氢氧化钙 | 水 |
| 硫酸铜溶液 | 硫酸铜 | 水 |
| 白磷的二硫化碳溶液 | 白磷 | 二硫化碳 |
17.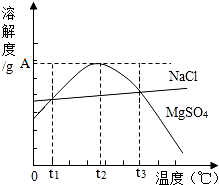 如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )
如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )
 如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )
如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )| A. | 只有在t1℃时,NaCl和MgSO4的溶解度才相等 | |
| B. | t1℃~t2℃,MgSO4的溶解度随温度升高而增大 | |
| C. | 在t2℃时,MgSO4溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,变成不饱和溶液 |
4.下列化学反应不属于置换反应的是( )
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
14.分离FeCl3、KCl、AgCl的混合物,应选用的试剂是( )
| A. | 水、硝酸银、稀硝酸 | B. | 水、氢氧化钠、稀盐酸 | ||
| C. | 水、氢氧化钾、稀硝酸 | D. | 水、氢氧化钾、稀盐酸 |
1.下列关于分子和原子的叙述正确的是( )
| A. | 原子是不能再分的最小粒子 | B. | 原子是化学变化中的最小粒子 | ||
| C. | 分子的质量和体积都比原子大 | D. | 分子是保持物质性质的最小粒子 |
19.写出下列表格中相应的化学符号或表示的意义或名称
| 化学符号 | NaOH | 2H2 | 3个碳酸根离子 | $\stackrel{+3}{Al}$2O3 | FeSO4 |
| 表示意义或名称 | 氢氧化钠 | 二个氢 分子 | 3CO32- | 氧化铝中铝元素显+3价 | 硫酸亚铁 |