题目内容
14.我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱,那里的农民冬天捞碱、夏天晒盐,试用你学过的知识说明其中的道理(不同温度下相关的溶解度数据下表).| 温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 温度(℃) | 0 | 10 | 20 | 30 | … | 90 | |
| 纯碱(克) | 7.1 | 12.5 | 21.5 | 38.8 | … | 43.9 | |
分析 “冬天捞碱,夏天晒盐”依据的是氯化钠与碳酸钠的溶解受温度影响不同的原理进行的,通过题目中的信息,分析两种物质的溶解度变化特点,进行分解答.
解答 解:由Na2CO3的部分温度下的溶解度表可知,碳酸钠的溶解度受温度影响变化较大,溶解度受温度影响变化比较大的固体物质一般用降温结晶的方法获得晶体;冬天气温低,碳酸钠的溶解度减小,碳酸钠易结晶析出.
由NaCl的部分温度下的溶解度表可知,氯化钠的溶解度受温度影响变化不大,溶解度受温度影响变化比较小的固体物质一般用蒸发结晶的方法获得晶体;夏天温度高,水分蒸发快,氯化钠乙结晶析出.
故答案为:冬天捞碱:碳酸钠的溶解度受温度影响变化较大,冬天气温低,碳酸钠的溶解度减小,碳酸钠易结晶析出;
夏天晒盐:氯化钠的溶解度受温度影响变化不大,夏天温度高,水分蒸发快,氯化钠乙结晶析出.
点评 本题难度不大,掌握降温结晶和蒸发结晶的原理并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
5.在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )
| 物质 | M | N | Q | P |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | X | 26 | 2 | 12 |
| A. | 该变化的基本反应类型是分解反应 | B. | 反应后物质X的值为l3 | ||
| C. | 反应中N、P的质量比为5:4 | D. | 物质Q可能是该反应的催化剂 |
2.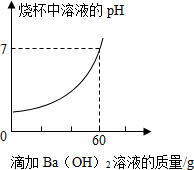 某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:
某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:
(已知BaCl2溶液的pH=7)
请回答下列问题:
(1)表中的m=2.33克.
(2)20克该品牌洁厕灵溶液中H2SO4的质量是多少?
(3)若在滴定的过程中,滴加了60克氢氧化钡溶液后即停止滴加,过滤,在滤液中再加入7.86克水,则此时滤液的溶质质量分数为多少?
 某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:
某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:| 滴加氢氧化钡溶液的质量/克 | 5 | 10 | 25 |
| 烧杯中产生沉淀的质量/克 | 1.165 | m | 4.66 |
请回答下列问题:
(1)表中的m=2.33克.
(2)20克该品牌洁厕灵溶液中H2SO4的质量是多少?
(3)若在滴定的过程中,滴加了60克氢氧化钡溶液后即停止滴加,过滤,在滤液中再加入7.86克水,则此时滤液的溶质质量分数为多少?
9.用冷却热的饱和溶液的方法得到晶体的过程(晶体不含结晶水)中,保持不变的时是( )
| A. | 溶剂的质量 | B. | 溶质的质量分数 | C. | 溶解度 | D. | 溶液的质量 |
4.下表列出了一定温度下每立方厘米活性炭所能吸附的常见气体的体积,分析表中数字与气体的组成、性质等的关系,你认为下列结论中正确的是②④.
①气体分子中所含原子个数多时,气体易被吸附. ②沸点越高的气体,越易被吸附.
③气体是化合物时,易被吸附. ④气体的相对分子质量越大,越易被吸附.
| 气体 性质 | H2 | CO2 | O2 | N2 | Cl2 |
| 气体的沸点/℃ | -252 | -78 | -183 | -196 | -34 |
| 被吸附体积/mL | 4.5 | 97 | 35 | 11 | 494 |
③气体是化合物时,易被吸附. ④气体的相对分子质量越大,越易被吸附.

 电池在现代生活中用途越来越广泛,小明想了解电池的工作原理,在网上找到如图,箭头表示电流的方向,请帮小明判断该电池的正极是铜片(填“铜片”或“锌片”),它的能量转化是化学能转化为电能.
电池在现代生活中用途越来越广泛,小明想了解电池的工作原理,在网上找到如图,箭头表示电流的方向,请帮小明判断该电池的正极是铜片(填“铜片”或“锌片”),它的能量转化是化学能转化为电能.