题目内容
2.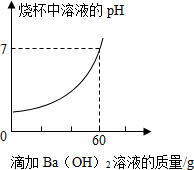 某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:
某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动 小组想测定20克该品牌洁厕灵溶液中H2SO4和HCl的质量.取20克该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:| 滴加氢氧化钡溶液的质量/克 | 5 | 10 | 25 |
| 烧杯中产生沉淀的质量/克 | 1.165 | m | 4.66 |
请回答下列问题:
(1)表中的m=2.33克.
(2)20克该品牌洁厕灵溶液中H2SO4的质量是多少?
(3)若在滴定的过程中,滴加了60克氢氧化钡溶液后即停止滴加,过滤,在滤液中再加入7.86克水,则此时滤液的溶质质量分数为多少?
分析 氢氧化钡和稀盐酸反应生成氯化钡和水,和稀硫酸反应生成硫酸钡沉淀和水,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)由表中数据可知,加入10g氢氧化钠溶液后继续加入时仍然产生沉淀,因此当加入10g氢氧化钠溶液时,m=1.165×2=2.33,
故填:2.33.
(2)设20g该品牌洁厕灵溶液中H2SO4的质量为x,
Ba(OH)2+H2SO4═BaSO4↓+2H2O,
98 233
x 4.66g
$\frac{98}{x}$=$\frac{233}{4.66g}$,
x=1.96g,
答:20g该品牌洁厕灵溶液中H2SO4的质量是1.96g.
(3)60g氢氧化钡溶液中钡离子质量为:60g×17.1%×$\frac{137}{171}$×100%=8.22g,
4.66g硫酸钡中钡离子质量为:4.66g×$\frac{137}{233}$×100%=2.74g,
反应生成的氯化钡质量为:(8.22g-2.74g)÷($\frac{137}{208}$×100%)=8.32g,
此时滤液的溶质质量分数为:$\frac{8.32g}{20g+60g-4.66g+7.86g}$×100%=10%,
答:此时滤液的溶质质量分数为10%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
13.往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,待反应完成后再过滤,可能存在的情况是( )
| A. | 滤纸上只有Ag,滤液中只有Ag+、Cu2+、Zn2+、Fe2+ | |
| B. | 滤纸上只有Ag、Cu,滤液中只有Ag+、Zn2+、Fe2+ | |
| C. | 滤纸上只有Ag、Zn、Fe,滤液中只有Zn2+、Fe2+ | |
| D. | 滤纸上只有Ag、Fe,滤液中只有Zn2+、Fe2+ |
10.有M、N、X、Y四种物质,在一定条件下充分反应后,测得反应物和产物在反应前后的质量如表所示,对该反应的下列说法错误的是( )
| 物质 | M | N | X | Y |
| 反应前质量/g | 2 | 20 | 34 | 0 |
| 反应后质量/g | 2 | 38 | 0 | 16 |
| A. | 该反应属于分解反应 | B. | 该反应属于化合反应 | ||
| C. | M在反应中可能作催化剂 | D. | 该反应生成的N、Y的质量比为9:8 |
7.下表粒子中是阳离子的是B(填字母,下同).互为同位素的是AD.B与C是同种元素.
| 质子 | 中子 | 电子 | |
| A | 14 | 14 | 14 |
| B | 26 | 30 | 24 |
| C | 26 | 30 | 26 |
| D | 14 | 16 | 14 |
14.我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱,那里的农民冬天捞碱、夏天晒盐,试用你学过的知识说明其中的道理(不同温度下相关的溶解度数据下表).
| 温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 温度(℃) | 0 | 10 | 20 | 30 | … | 90 | |
| 纯碱(克) | 7.1 | 12.5 | 21.5 | 38.8 | … | 43.9 | |
11.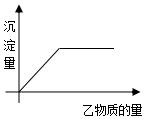 向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
 向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )| 组别 | 甲 | 乙 |
| A | FeCl3溶液 | NaOH溶液 |
| B | NaOH溶液 | CO2气体 |
| C | CuSO4溶液 | BaCl2 |
| D | 一定量海水 | AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
