题目内容
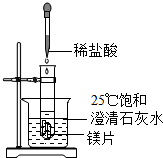 化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水变浑浊.
化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水变浑浊.(一)石灰水变浑浊的原因是:
(1)镁和稀盐酸的反应
(2)氢氧化钙的溶解度
(二)甲同学测得反应后试管内溶液的pH<7
(1)该溶液呈
(2)该溶液pH<7的可能原因是:
①MgCl2溶液的pH<7;
②
(三)乙同学将反应后试管内溶液冷却,加入镁粉并滴入酚酞,溶液颜色无变化,再加热,发现溶液慢慢浑浊且变红.
【猜想】对实验中“溶液慢慢浑浊且变红”的原因,乙同学提出猜想:MgCl2+2H2O=Mg(OH)2↓+2HCl.
大家都认为此猜想不合理,理由是
【查阅】资料1:Mg(OH)2难溶解于水,升高温度可加大其在水中的溶解度.
资料2:K、Ca、Na、Mg等活泼金属在一定条件下能与水反应,产生碱和气体.
【实验】丙同学在滴有酚酞的热水中加入镁粉,观察到液体慢慢变红并浑浊,镁粉表面产生气泡.收集并点燃气体,发现能燃烧,该气体是
考点:实验探究物质的性质或变化规律,固体溶解度的影响因素,酸的化学性质,溶液的酸碱性与pH值的关系,物质发生化学变化时的能量变化,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(一)根据金属与酸发生置换反应放热,以及氢氧化钙的溶解度随温度的升高而减小来分析;(二)根据溶液的酸碱性与酸碱度的关系以及酸可能过量来分析;(三)【猜想】根据酸碱不能共存来分析;
【实验】根据反应过程和气体的性质来确定气体种类;镁能与热水反应生成氢氧化镁和氢气.
【实验】根据反应过程和气体的性质来确定气体种类;镁能与热水反应生成氢氧化镁和氢气.
解答:解:(一)镁与稀盐酸反应要放出热量,而氢氧化钙的溶解度随温度的升高而减小,所以石灰水变浑浊;
故答案为:(1)放热;(2)减小;
(二)pH小于7,溶液呈酸性;呈酸性的原因还可能是盐酸过量;
故答案为:(1)酸;(2)滴加的稀盐酸过量;
(三)【猜想】氢氧化镁是一种碱,不能与盐酸共存;
【实验】根据题干信息可知,该气体是镁与水反应生成的,且具有可燃性,所以是氢气;该反应是镁与水在加热的条件下反应生成氢氧化镁和氢气.
故答案为:Mg(OH)2能和HCl发生反应;H2;Mg+2H2O
Mg(OH)2↓+H2↑.
故答案为:(1)放热;(2)减小;
(二)pH小于7,溶液呈酸性;呈酸性的原因还可能是盐酸过量;
故答案为:(1)酸;(2)滴加的稀盐酸过量;
(三)【猜想】氢氧化镁是一种碱,不能与盐酸共存;
【实验】根据题干信息可知,该气体是镁与水反应生成的,且具有可燃性,所以是氢气;该反应是镁与水在加热的条件下反应生成氢氧化镁和氢气.
故答案为:Mg(OH)2能和HCl发生反应;H2;Mg+2H2O
| ||
点评:本题考查的知识点较多,难点是化学实验方案的设计与评价,学会运用猜想与事实验证的方法和技巧处理实验问题.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 根据如图所示写出该反应的化学方程式
根据如图所示写出该反应的化学方程式

 (1)电源A端为
(1)电源A端为 如图,用红磷燃烧来测定空气中氧气的含量,发生的实验现象是:
如图,用红磷燃烧来测定空气中氧气的含量,发生的实验现象是: