题目内容
7.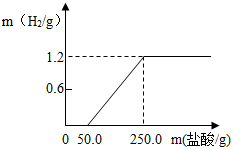 某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应).请回答:
某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应).请回答:(1)铝片中铝单质的质量为10.8g.
(2)求被氧化的铝的质量占未氧化时铝片总质量的质量分数,写出计算过程.
分析 (1)图象为产生氢气质量随所加盐酸质量变化情况.根据图象可知,放出氢气质量为1.2g;未被氧化的铝与盐酸发生置换反应,可以生成氯化铝和氢气;由反应放出氢气的质量,根据反应的化学方程式,计算与酸反应的铝片的质量;
(2)根据产生氢气的图象,当加入50.0g稀盐酸时开始与铝片发生反应,直到加入250.0g盐酸时恰好完全反应.由与氧化铝反应所消耗盐酸的质量,根据反应的化学方程式计算氧化铝的质量,由氧化铝中铝元素的质量分数求得被氧化的铝的质量,最后计算出被氧化的铝的质量占未氧化时铝片总质量的质量分数.
解答 解:(1)根据产生氢气的质量与消耗盐酸的质量图,可得生成氢气质量为1.2g;
设与200.0g盐酸反应的铝的质量为x
2Al+6HCl═2AlCl3+3H2↑
54 219
x 200.0g×21.9%
$\frac{54}{x}$=$\frac{219}{200.0g×21.9%}$
x=10.8g
(2)根据图象,与氧化铝反应的盐酸的质量为50.0g;设氧化铝的质量为y
Al2O3+6HCl═2AlCl3+3H2O
102 219
y 50.0g×21.9%
$\frac{102}{y}$=$\frac{219}{50.0g×21.9%}$
y=5.1g
被氧化的铝的质量=5.1g×$\frac{27×2}{27×2+16×3}$×100%=2.7g
被氧化的铝的质量占未氧化时铝片总质量的质量分数=$\frac{2.7g}{2.7g+10.8g}$×100%=20%
答:铝片中铝单质的质量为10.8g;
被氧化的铝的质量占未氧化时铝片总质量的质量分数为20%.
点评 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线起点表示开始与铝发生反应放出氢气,曲线的折点表示此时恰好完全反应.

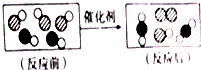
| A. | 分子在化学变化中可分 | |
| B. | 化学反应前后,原子种类不变 | |
| C. | 参加反应的两种分子的个数比为3:2 | |
| D. | 生成物中有单质 |
| A. | 碳酸钠 | B. | 盐酸 | C. | 二氧化碳 | D. | 硫酸铜 |
①天平保持平衡 ②铝也有剩余 ③天平指针偏向放镁的一方
④天平指针偏向放铝的一方 ⑤铝完全溶解.
| A. | ②③ | B. | ①② | C. | ①⑤ | D. | ④⑤ |
| 实验 序号 | 过氧化氢溶液 浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
①温度:其他条件相同时,温度越高反应速率越快;
②浓度:其他条件相同时,浓度越高反应速率越快;
③催化剂:该反应用二氧化锰作催化剂能大大加快反应速率.
(2)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是20℃时5%过氧化氢溶液中加入少量二氧化锰.
(3)实验室需配制450克5%的过氧化氢溶液,其操作为:往一定量30%的过氧化氢溶液中加入375毫升水(水的密度可看做1g•cm-3),然后用玻璃棒搅拌均匀.配制过程中还需用到的玻璃仪器有:量筒、烧杯.
| A. | 30% | B. | 70% | C. | 56% | D. | 24% |