题目内容
16.现有镁和铁的混合物4克与足量的稀硫酸反应产生了氢气0.2克,则混合物中铁的质量分数是多少( )| A. | 30% | B. | 70% | C. | 56% | D. | 24% |
分析 根据镁和铁与硫酸反应方程式,和混合物的质量及生成氢气的质量列方程组计算解答即可.
解答 解:设混合物中铁的质量是x,则镁的质量是4g-x
则有Fe+H2SO4═FeSO4+H2↑
56 2
x $\frac{x}{28}$
Mg+H2SO4═MgSO4+H2↑
24 2
4g-x $\frac{4g-x}{12}$
由题意可知,生成氢气的质量是0.2g,则有$\frac{x}{28}$+$\frac{4g-x}{12}$=0.2g,解得x=2.8g;
$\frac{2.8g}{4g}$×100%=70%;
故选:B.
点评 本题考查了依据方程式之间的计算,了解金属与酸反应原理,及已知条件,并结合题意灵活分析解答.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
6.在一个密闭容器内有X、Y、Z、R在一定条件下反应一段时间后,测得反应前后各物质的质量如下:
处理数据后可得出:
(1)反应物为X,生成物为Z、R,催化剂为Y.
(2)此反应的反应基本类型为分解反应.
| 物质 | X | Y | Z | R |
| 反应前质量(g) | 10 | 10 | 10 | 10 |
| 反应后质量(g) | 0 | 10 | 12 | 18 |
(1)反应物为X,生成物为Z、R,催化剂为Y.
(2)此反应的反应基本类型为分解反应.
4.Na的摩尔质量为( )
| A. | 23 | B. | 23g | C. | 23mol | D. | 23g/mol |
11.以下摘录的是某些同学对所学知识的整理归纳,你认为正确的是( )
| A. | 合金含两种或两种以上金属 | |
| B. | 含有氧元素的化合物都属于氧化物 | |
| C. | 酸碱中和生成盐和水,所以盐溶液都为中性 | |
| D. | 若使可燃物的温度降到着火点以下就能灭火 |
1.金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应后有无金属析出的情况如表所示.它们的金属活动性由强到弱的顺序为( )
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
| A. | X Mn Y Ni Z | B. | Z Ni Y Mn X | ||
| C. | Z Mn Y Ni X | D. | X Mn Ni Y Z |
5.下列物质中,不属于混合物的是( )
| A. | 冰水混合物 | B. | 洁净的空气 | C. | 精制加碘盐 | D. | 医用酒精 |
6.下列说法正确的是( )
| A. | 硝酸铵溶入水放热 | |
| B. | 赤铁矿石的主要成分是Fe3O4 | |
| C. | 钢的性能优良,所以钢是很纯的铁 | |
| D. | 在金属活动性顺序里,位于氢前的金属能置换出盐酸、稀硫酸中的氢 |
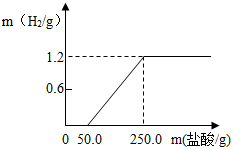 某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应).请回答:
某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应).请回答: