题目内容
17.回收再利用生锈的铁制品是保护金属资源的一种有效途径.废铁粉中Fe2O3含量大约在80%(其余20%为铁),工业上常用一氧化碳将其还原,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,若回收100t这样的废铁粉可以得到76t铁.
分析 工业上常用一氧化碳将其还原,生成铁和二氧化碳,写出反应的化学方程式即可;由废铁粉中Fe2O3的质量、氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出铁的质量.
解答 解:工业上常用一氧化碳将其还原,生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
设可以得到铁的质量为x
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
100t×80% x
$\frac{160}{112}=\frac{100t×80%}{x}$ x=56t
回收100t这样的废铁粉可以得到铁的质量为56t+100t×20%=76t.
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;回收100t这样的废铁粉可以得到76t.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
8.下列化学用语与所表述的意义不相符的是( )
| A. | 2H-2个氢元素 | B. | N2-氮气 | C. | CuO-氧化铜 | D. | 2H2O-2个水分子 |
5.下列说法错误的是( )
| A. | 人体所需要的大多数维生素能在体内合成 | |
| B. | 地球上各种生物活动所需要的能量都来自于太阳能 | |
| C. | 食物中能供给人们生命活动所需要能量的物质都是有机化合物 | |
| D. | 蛋白质和淀粉、纤维素都是有机高分子化合物 |
12.下列物质的用途主要是由其化学性质决定的是( )
| A. | 干冰可用于人工降雨 | B. | 活性炭可用于除去冰箱中的异味 | ||
| C. | 铜丝可用作导线 | D. | 硫酸可用于金属除锈 |
9.下列过程,属于物理变化的是( )
| A. | 蜡烛燃烧 | B. | 面团发酵 | C. | 酒精挥发 | D. | 燃放烟花 |
6.如图为某化学反应的微观模拟示意图,下列说法中正确的是( )


| A. | 该反应属于置换反应 | |
| B. | 图示中x的数值为1 | |
| C. | 反应前后氢元素的化合价发生了改变 | |
| D. | 反应中甲、丙两物质的质量比为1:1 |
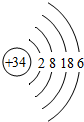 ,硒单质是红色或灰色粉末,带灰色金属光泽,导电性随光照强度急剧变化,可制半导体和光敏材料.硒在空气中燃烧发出蓝色火焰,生成二氧化硒.工业是可以利用反应Na2SeSO3→Na2SO3+Se来制备硒单质.
,硒单质是红色或灰色粉末,带灰色金属光泽,导电性随光照强度急剧变化,可制半导体和光敏材料.硒在空气中燃烧发出蓝色火焰,生成二氧化硒.工业是可以利用反应Na2SeSO3→Na2SO3+Se来制备硒单质.