题目内容
加热5.61g的高锰酸钾与氯酸钾的混合物至质量不再变化时,剩余固体的质量变为4.33g.求混合物中氯酸钾的质量分数.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,由质量守恒定律,固体质量减少的质量为产生氧气的质量,据此列式计算出原混合物中氯酸钾的质量即可.
解答:解:产生氧气的质量为5.61g-4.33g=1.28g.
设混合物中氯酸钾的质量为x,则高锰酸钾的质量为(5.61g-x),设加热高锰酸钾生成氧气的质量为y,加热氯酸钾生成氧气的质量为z,
2KMnO4
K2MnO4+MnO2+O2↑
316 32
5.61g-x y
=
y=
2KClO3
2KCl+3O2↑
245 96
x z
=
x=
+
=1.28g x=2.45g.
答:原混合物中氯酸钾的质量为2.45g.
设混合物中氯酸钾的质量为x,则高锰酸钾的质量为(5.61g-x),设加热高锰酸钾生成氧气的质量为y,加热氯酸钾生成氧气的质量为z,
2KMnO4
| ||
316 32
5.61g-x y
| 316 |
| 32 |
| 5.61g-x |
| y |
| (5.61g-x)×32 |
| 316 |
2KClO3
| ||
| △ |
245 96
x z
| 245 |
| 96 |
| x |
| z |
| 96x |
| 245 |
| (5.61g-x)×32 |
| 316 |
| 96x |
| 245 |
答:原混合物中氯酸钾的质量为2.45g.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氧气的质量是正确解答本题的前提和关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
运用100mL量筒进行相关实验,操作正确的是( )
A、 量取20.2mL水 |
B、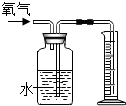 收集80mL氧气 |
C、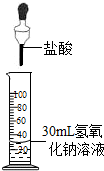 30mL氢氧化钠溶液中滴入盐酸 |
D、 配制100g10%的氯化钾溶液 |
某物质M是SO2、SO3、O2的混合物,其中硫元素的质量分数为40%,则这三种物质的质量比可能是( )
| A、8:7:2 |
| B、8:10:3 |
| C、4:5:2 |
| D、3:5:2 |