题目内容
6.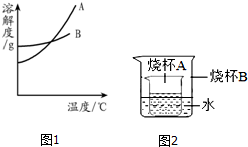 水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:
水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:| 温度/°C 溶解度/g | 0 | 20 | 40 | 60 | 80 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
(2)若用溶质质量分数为10%的NaCl溶液来配制100g溶质质量分数为0.9%的氯化钠溶液,需加水91 g.
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是降温结晶法或冷却热饱和溶液.
(4)60℃时,向两个分别盛有50g NaCl和KNO3的烧杯中,各加入100g的水,充分溶解后为饱和溶液的是NaCl溶液;将上述烧杯中剩余固体全部溶解,变为不饱和溶液,下列方法能实现的是C E(填序号).
A.升温 B.加入该溶质 C.加入适量水
D.降温 E.加入足量该溶质的不饱和溶液
(5)如图2所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,原因是生石灰与与水反应放热,使氢氧化钙溶解度减小而析出..
分析 根据题目信息和溶解度曲线可知:A、B两种固体物质的溶解度,都是随温度升高而增大,而A的溶解度随温度的升高变化比B大;A是硝酸钾的溶解度曲线,因为A的溶解度随温度的升高变化比B大;设需加水的质量为x,100g×10%=(100g+x)×0.9%,x=91g;硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是:降温结晶法或冷却热饱和溶液,因为A的溶解度随温度的升高变化比B大;60℃时,向两个分别盛有50gNaCl和KNO3的烧杯中,各加入100g的水,充分溶解后为饱和溶液的是氯化钠溶液,因为在该温度下氯化钠的溶解度比硝酸钾小,并且是易溶物质;将上述烧杯中剩余固体全部溶解,变为不饱和溶液的方法是:加入适量水、加入足量该溶质的不饱和溶液;如图2所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,原因是生石灰与与水反应放热,使氢氧化钙溶解度减小而析出.
解答 解:(1)A是硝酸钾的溶解度曲线,因为A的溶解度随温度的升高变化比B大;故答案为:硝酸钾
(2)设需加水的质量为x,100g×10%=(100g+x)×0.9%,x=91g;故答案为:91
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是:降温结晶法或冷却热饱和溶液,因为A的溶解度随温度的升高变化比B大;故答案为:降温结晶法或冷却热饱和溶液
(4)60℃时,向两个分别盛有50gNaCl和KNO3的烧杯中,各加入100g的水,充分溶解后为饱和溶液的是氯化钠溶液,因为在该温度下氯化钠的溶解度比硝酸钾小,并且是易溶物质;60℃时,向两个分别盛有50gNaCl和KNO3的烧杯中,各加入100g的水,充分溶解后为饱和溶液的是氯化钠溶液,因为在该温度下氯化钠的溶解度比硝酸钾小,并且是易溶物质;将上述烧杯中剩余固体全部溶解,变为不饱和溶液的方法是:加入适量水、加入足量该溶质的不饱和溶液;故答案为:NaCl; C E;
(5)如图2所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,原因是生石灰与与水反应放热,使氢氧化钙溶解度减小而析出;故答案为:生石灰与与水反应放热,使氢氧化钙溶解度减小而析出
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算和结晶的方法等,有关的计算要准确,本考点主要出现在选择题和填空题中.

| A. | 原子都能转变成离子 | B. | 带电的粒子一定是离子 | ||
| C. | 阴离子都带负电 | D. | 原子核都是由质子、中子构成的 |
| A. | 温室效应 | B. | 玉树地震 | C. | 冰川融化 | D. | 形成酸雨 |
| A. | Cl | B. | K | ||
| C. | I | D. | 无元素化合价升高 |

| A. | 粒子A在化学反应中易得到电子变成阴离子 | |
| B. | 粒子A与B都是原子 | |
| C. | 粒子A与B都不显电性 | |
| D. | 粒子A与B属于不同元素的粒子 |