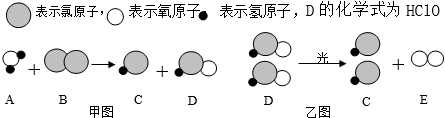
题目内容
15.用化学方程式解释下列问题:(1)铝具有良好的抗腐蚀性能,其原因是4Al+3O2=2Al2O3;
(2)氢氧化钠露置在空气中会变质,其原因是2NaOH+CO2=Na2CO3+H2O;
(3)食品包装袋内常用生石灰做干燥剂,其原因是CaO+H2O=Ca(OH)2.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)铝具有良好的抗腐蚀性能,是因为铝在空气中能与氧气反应,表面生成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2=2Al2O3.
(2)氢氧化钠露置在空气中会变质,是因为氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O.
(3)食品包装袋内常用生石灰做干燥剂,其原因是生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2.
故答案为:(1)4Al+3O2=2Al2O3;(2)2NaOH+CO2=Na2CO3+H2O;(3)CaO+H2O=Ca(OH)2.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
3.酸、碱和盐的溶解性表(室温)是化学学习的重要工具.下表列出了部分酸、碱、盐在室温时的溶解性,请根据此表信息回答下列问题.
(1)写出硫酸钠的化学式Na2SO4;
(2)只用水就能区分碳酸钡和氯化钙的原因是它们的溶解性不同;
(3)在实验室里浓硝酸要密封保存,原因是浓硝酸有挥发性;
(4)判断硝酸铜溶液与氢氧化钠溶液能否反应,若能反应,写出化学方程式及反应现象,若不能,说明理由2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;生成蓝色沉淀.
| OH- | Cl- | CO32- | SO42- | NO3- | |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Cu2+ | 不 | 溶 | - | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 不 | 溶 |
| Ca2+ | 微 | 溶 | 不 | 微 | 溶 |
(2)只用水就能区分碳酸钡和氯化钙的原因是它们的溶解性不同;
(3)在实验室里浓硝酸要密封保存,原因是浓硝酸有挥发性;
(4)判断硝酸铜溶液与氢氧化钠溶液能否反应,若能反应,写出化学方程式及反应现象,若不能,说明理由2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;生成蓝色沉淀.